Физические свойства веществ и химических элементов
Одно из основных физических свойств, на которое следует обратить внимание, это плотность. Плотность — это масса вещества или элемента, разделенная на его объем
Она показывает, насколько компактно упакованы атомы или молекулы в материале. Некоторые вещества и элементы имеют высокую плотность, например, песок или железо, а другие — низкую, например, воздух или гелий.
Также важно обратить внимание на температуру плавления и кипения. Температура плавления — это температура, при которой твердое вещество превращается в жидкое, а температура кипения — это температура, при которой жидкое вещество превращается в газ. Эти значения могут быть различными для разных веществ и элементов
Например, вода плавится при 0°C и кипит при 100°C, в то время как золото плавится при 1064°C и кипит при 2807°C
Эти значения могут быть различными для разных веществ и элементов. Например, вода плавится при 0°C и кипит при 100°C, в то время как золото плавится при 1064°C и кипит при 2807°C.
Один из способов определить простоту вещества или химического элемента — это проверить его электропроводность. Вещества и элементы могут быть проводниками, полупроводниками или непроводниками электричества. Проводники, такие как металлы, имеют высокую электропроводность, полупроводники, такие как кремний, имеют среднюю электропроводность, а непроводники, такие как стекло, имеют очень низкую электропроводность.
Важно также учитывать растворимость вещества или элемента. Растворимость — это способность вещества или элемента растворяться в другом веществе (растворителе) и образовывать раствор
Растворимость может быть высокой, низкой или отсутствовать полностью. Некоторые элементы, такие как натрий или калий, очень хорошо растворяются в воде, в то время как другие элементы, такие как серебро или свинец, практически не растворяются в воде.
Также обратите внимание на видимый цвет вещества или элемента. Они могут быть прозрачными, белыми, черными, красными или иметь другие цвета
Это может быть полезным показателем простоты вещества или элемента, так как некоторые элементы, такие как золото или серебро, обычно имеют характерные цвета.
И наконец, эти свойства можно использовать для определения простоты вещества или химического элемента. Например, простые элементы имеют обычно более высокую плотность, высокие температуры плавления и кипения, хорошую электропроводность и характерный цвет. В то время как сложные вещества могут иметь низкую плотность, низкие температуры плавления и кипения, плохую электропроводность и могут быть бесцветными.
- Плотность: высокая или низкая
- Температура плавления: высокая или низкая
- Температура кипения: высокая или низкая
- Электропроводность: высокая, средняя или низкая
- Растворимость: высокая, низкая или отсутствует
- Цвет: прозрачный, белый, черный, красный или другой
Знакомство с химией
Когда мы слышим слово «химия», сразу представляем человека, окружённого колбами, пробирками, наполненными веществами всевозможных цветов. Он записывает непонятные символы, которые нам кажутся иероглифами. Перед нами встает вопрос: что это за наука, какие задачи изучает? Ответ достаточно прост, предмет химии – вещества.

Химия — наука о веществах, их свойствах и превращениях в другие вещества.
Как и каждая наука, химия имеет свою историю развития. Первые химические знания появились до нашей эры, в Древнем Египте. Египтяне обладали химической наукой, которую называли «Священным искусством». Некоторые рецепты приготовления парфюмерии и лекарственных препаратов используют и до сих пор. Наверняка вы слышали об алхимиках и философском камне, с помощью которого, можно превратить любой металл в золото.
В современном представлении термин «химия» можно услышать в нескольких интерпретациях: химия как наука, а также продукты химического производства (одним словом химия). Мы не представляем наше существование без химических веществ. Просыпаясь утром, идём умываться: мыло, зубная паста ждут нас в ванной комнате. Ароматный чай и хрустящие хлопья на завтрак. Одежда, обувь, школьные принадлежности и многое другое мы получаем благодаря химическим технологиям.
Но также можно сказать, что химия – это вред. Неоднократно слышали о кислотных дождях, о гибели морских жителей из-за нефтяных пятен, о нитратах в овощах и фруктах и т. д.
Химия тесно связана с человечеством, является неотъемлемой его частью. Чтобы не наносить вред нашей планете, необходимо применять химические знания и рационально использовать вещества.
Именно благодаря своей многогранности химия применяется в каждой области:
- Медицина: лекарственные препараты, вакцины, искусственные органы, косметические средства;
- Искусство: живопись, архитектура, фотографии, изготовление ювелирных изделий, ковка, литье;
- Сельское хозяйство: удобрение, средства для борьбы с вредителями;
- Криминалистика: опознание личности по ДНК, отпечаткам пальцев, определение состава ядовитых и взрывчатых веществ;
- Строительство: производство строительных материалов, обработка древесины;
- Металлургия: без металлов не существует ни одна отрасль. Металлы и сплавы окружают нас повсюду;
- В быту: средство бытовой химии, при приготовлении обеда также применяем химические знания;
- Пищевая промышленность: молочная, мясная продукция, соусы, кондитерские изделия и т. д.;
- Охрана окружающей среды. На данный момент остро стоит проблема охраны окружающей среды. Деятельность человека губительно действует на планету. Но с помощью химических знаний, которые базируются на свойствах веществ, учёные находят способы очистки воды, почвы, воздуха от вредных веществ.
 (Источник)
(Источник)
Химия – наука очень обширная и включает в себя много разделов, которые имеют своё назначение и изучают вещества, их строение и свойства.
- Неорганическая химия или её ещё называют химия неживой природы. Предмет изучения химические элементы и их соединения;
- Биохимия изучает процессы, которые происходят в организмах при обмене веществ, дыхании и т. д.;
- Органическая химия или химия углерода. Это увлекательный раздел знакомит о множестве соединений, благодаря уникальным свойствам углерода;
- Физическая химия рассматривает закономерности реакций;
- Аналитическая химия, благодаря качественному и количественному анализу позволяет исследовать смеси.
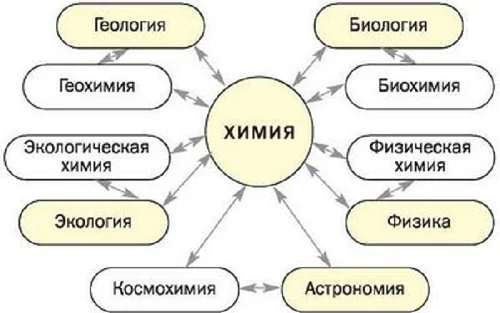
Чтобы овладеть химическими знаниями, необходимо изучить физику, биологию, а также математику. Как видно из схемы, химия тесно перекликается с другими науками.
Атомно-молекулярное учение. Мельчайшие частицы
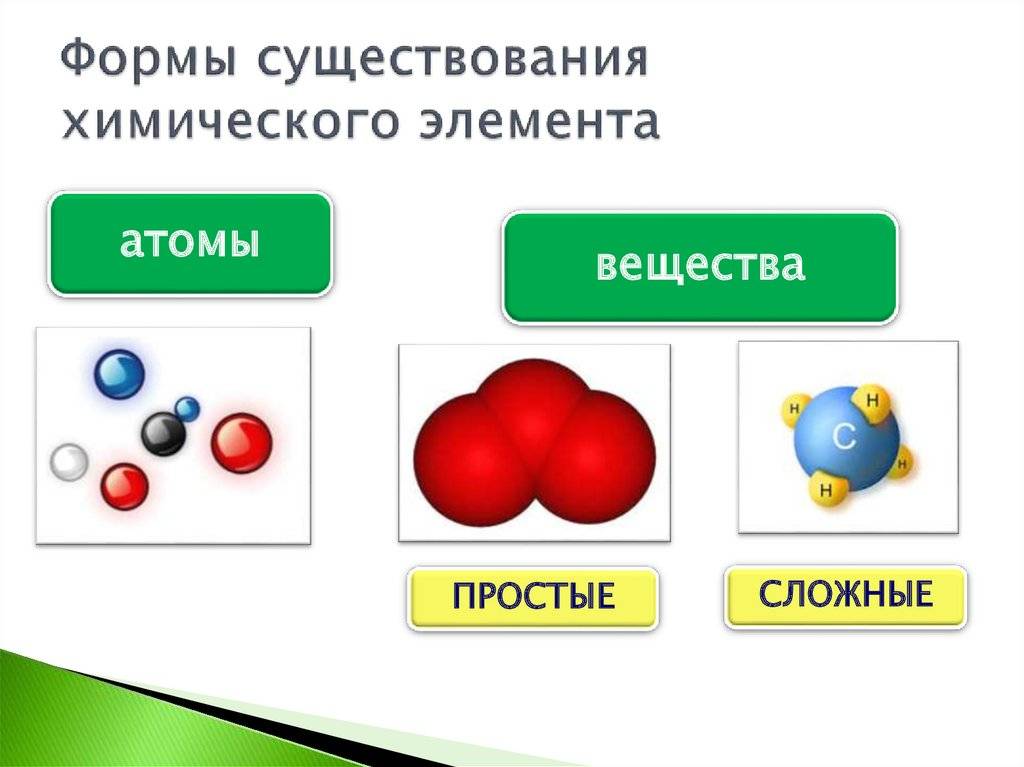
Как и каждая наука, химия имеет свои термины и понятия, которые изучаются на протяжении всего курса. Эти термины для вас будут не новыми, вы с ними знакомились на уроках физики и природоведения. А речь пойдёт об атомах, молекулах, химических элементах и веществах. Эти понятия являются основой атомно-молекулярного учения.
Рассмотрим подробно каждое понятие.
Атом
Наверняка вы в учебнике или кабинете химии видели периодическую систему химических элементов (ПСХЭ). Она имеет разный вид и структуру, с которой вы позже подробно познакомитесь. Классический вид периодической системы химических элементов изображён на рисунке.
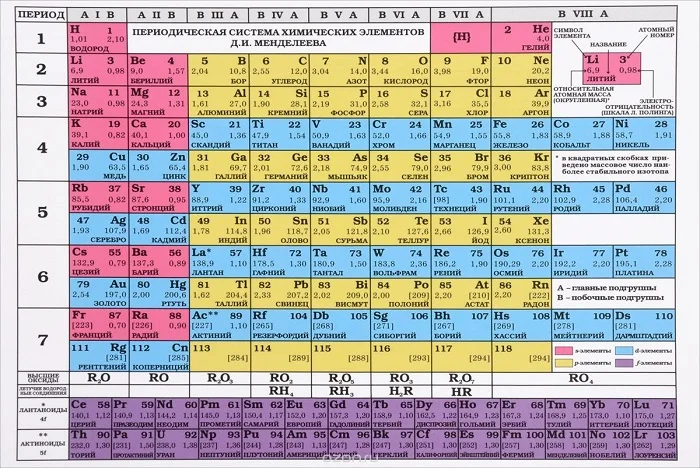
С уроков природоведения вам известно, что атомы это кирпичики мироздания.
Атом – мельчайшая частица химического элемента, которая отвечает за его свойства и химически неделима.
На данный момент известно 126 видов атомов – химических элементов. Какая связь между химическим элементом и атомом? Химический элемент состоит из атомов определённого вида. В чём состоит отличие этих понятий. Почему алхимики не могли найти философский камень? Почему железо или медь не превращаются в золото? Чтобы ответить на эти вопросы, необходимо рассмотреть строение атома.
Абсолютно каждый атом имеет положительно заряженное ядро и, вращающиеся вокруг него, отрицательные электроны.
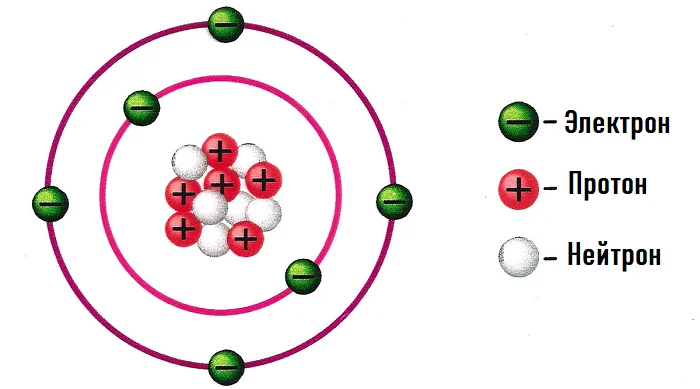
Самое тяжёлое в атоме – это ядро, которое состоит с протонов (имеют заряд +) и нейтронов (заряд 0).
Атом не имеет никакого заряда, иными словами нейтрален.
Число протонов = число электронов
Чтобы узнать количество частиц, необходимо определить порядковый номер элемента в ПСХЭ.
Например, если в состав атома входит 10 электронов и 10 протонов, посмотрев в периодическую систему, увидим, что данный набор частиц отвечает химическому элементу – Неон. Химический элемент Золото имеет 79 протонов и 79 электронов. Состав атомов, а точнее, количество протонов, не изменяется в ходе химических реакций. Именно по этой причине, алхимики не смогли найти рецепт философского камня.
Атомы (подобно буквам, которые соединяются в слоги, а потом в слова) соединяются в молекулы.
Молекула
Молекула – наименьшая частица вещества
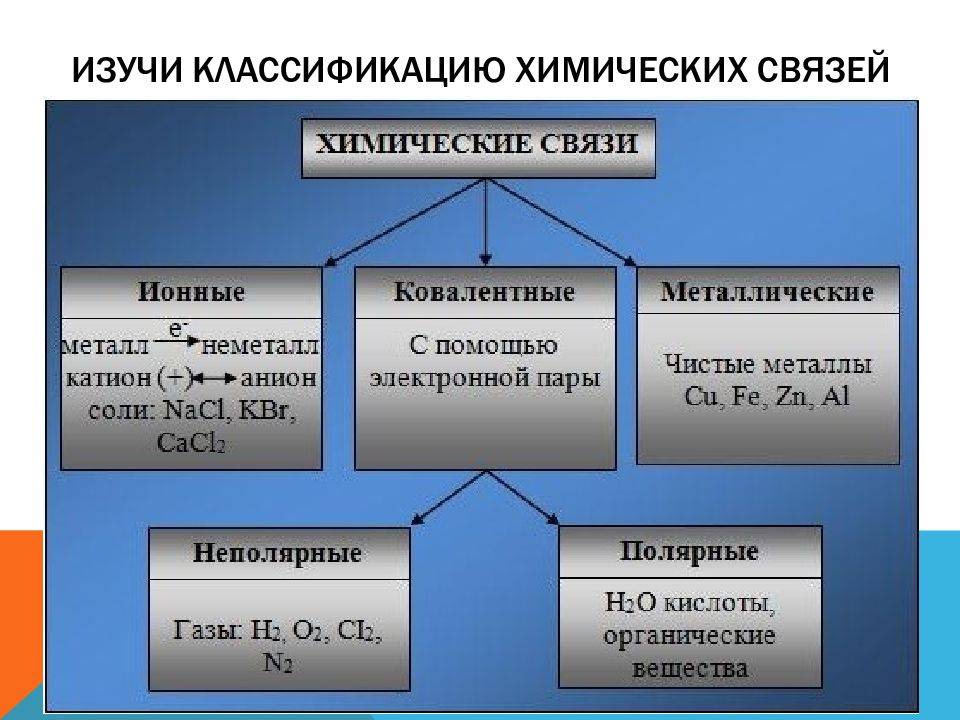
Как образуются молекулы? Снова проведём аналогию с буквами. Чтобы получилось читаемое и со смыслом слово, необходима определённая комбинация букв и чёткие правила. Также происходит и при образовании молекулы. Атомы соединяются в молекулу с помощью химических связей. Свойства молекул зависят от того, атомы каких элементов входят в их состав, а также каким образом они соединены между собой.
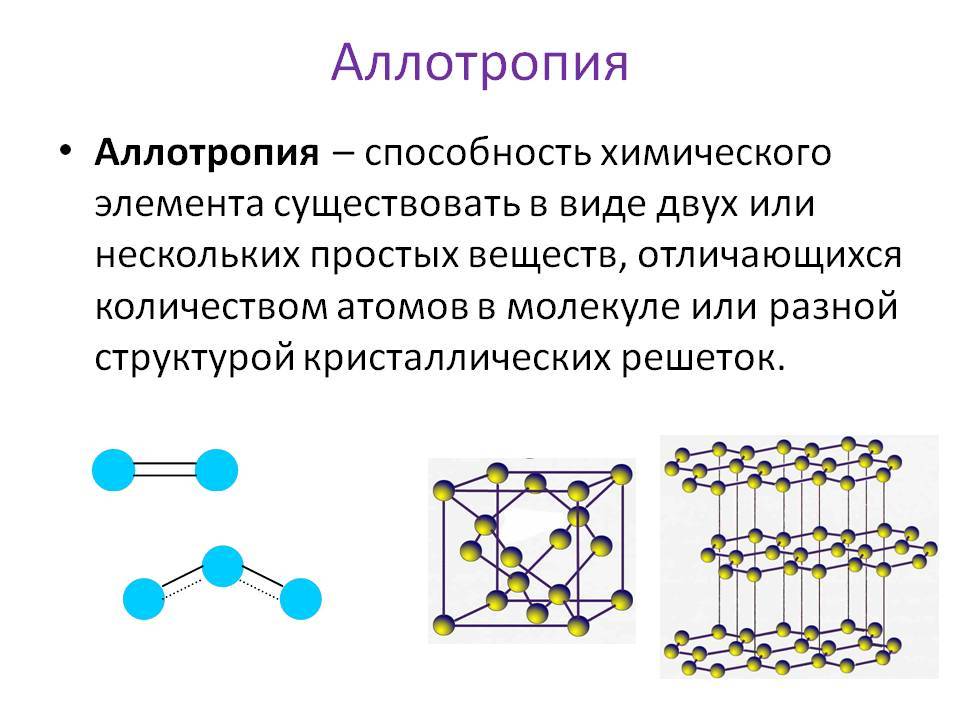
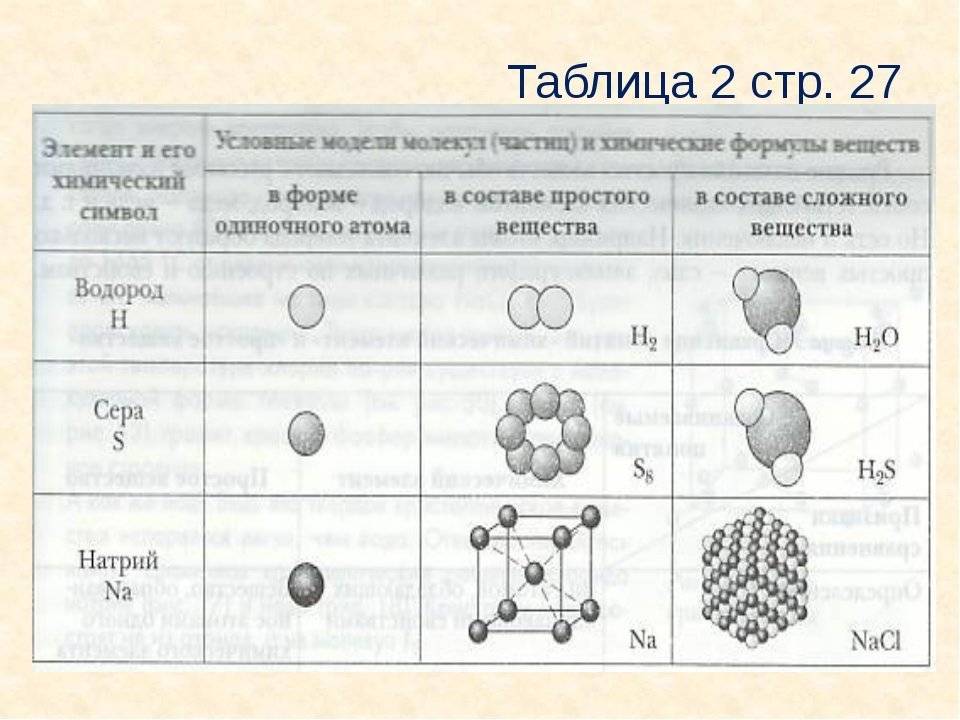
Рассмотрим на примере молекул веществ, которые образованные атомами кислорода, это кислород и озон. Обе эти молекулы образованы атомами химического элемента Кислород, но в состав озона, химическая формула которого О3, входит 3 атома Кислорода, а в молекулу кислорода, формула вещества О2 – два атома химического элемента Кислород.
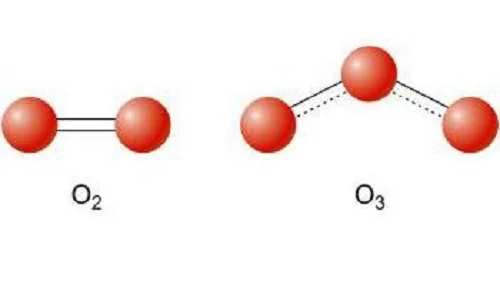
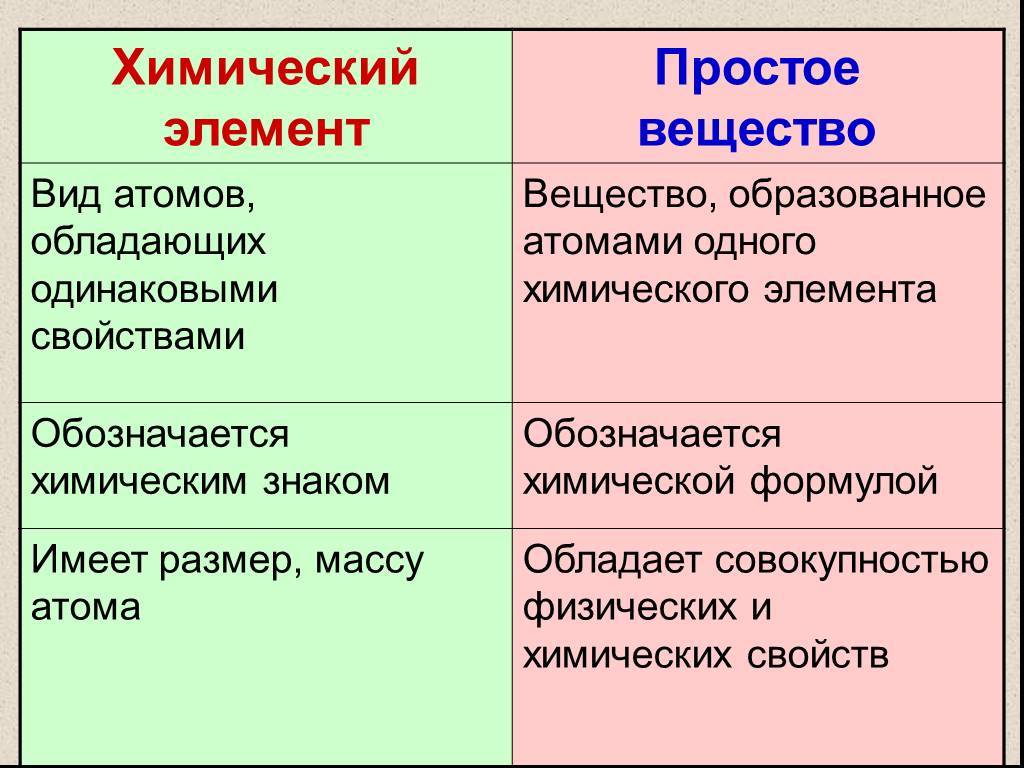
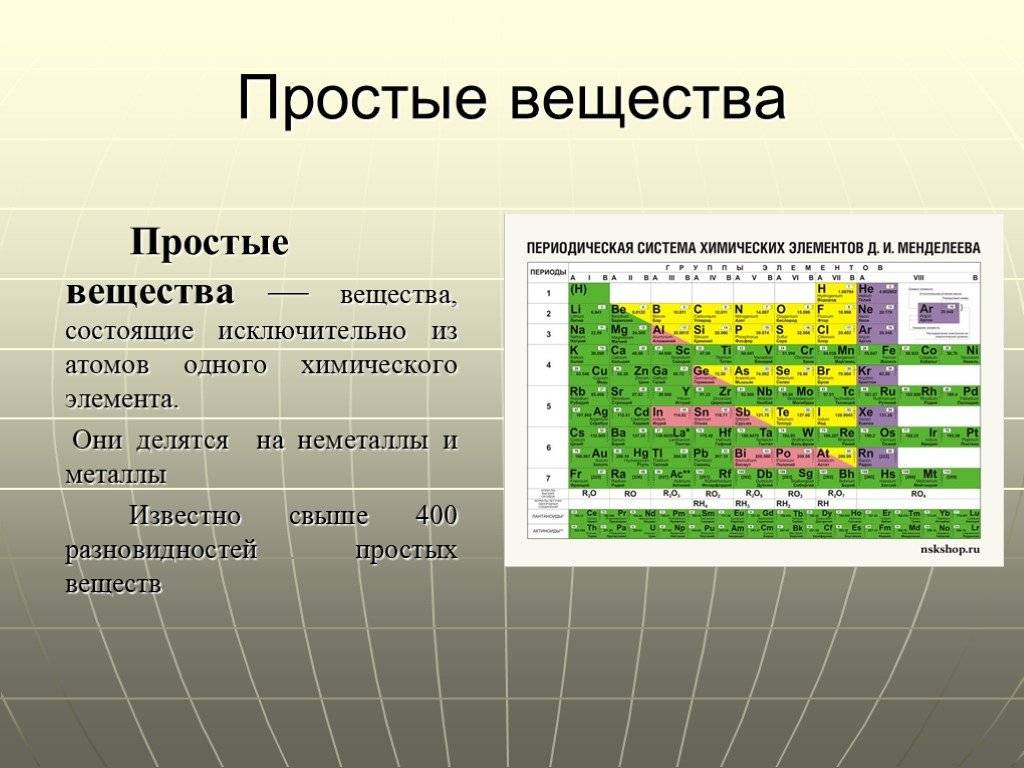
Данное явление называется аллотропией. Это явление существования простых веществ, образованных одинаковым химическим элементом, но различным по свойствам и строению.
Рекордсменом по образованию аллотропных форм является углерод, который существует в виде алмаза, графита, карбина, фуллеренов, углеродных нанотрубок.
Как видно из определения, атомы и молекулы – это частицы, но в чём их разница? Снова проведём аналогию с буквами и словами. Буквы – это атомы, слова – это молекулы. Буквы не могут состоять из слов, так же как и атомы не могут состоять из молекул.
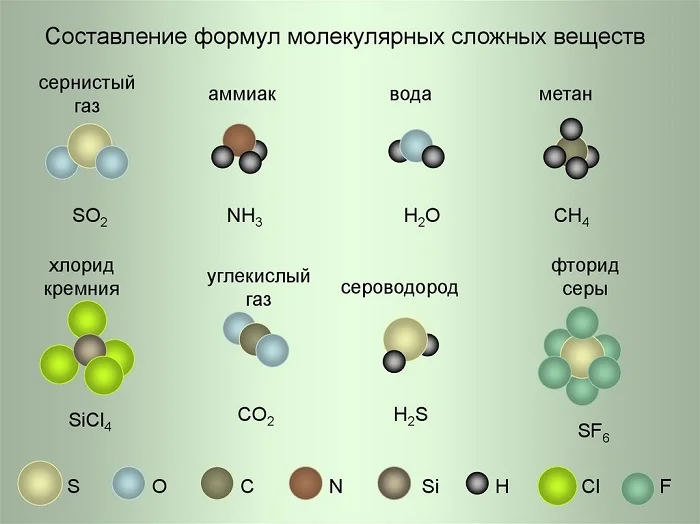
Молекула сернистого газа SO2 состоит из одного атома Серы и двух атомов Кислорода. Молекула аммиака состоит из одного атома Азота и трёх атомов Водорода и т. д.
Таким образом, мы видим, что все вещества состоят из атомов химических элементов. Живая и неживая природа – это также комбинация химических элементов.
Ионы
Что происходит с атомом, если он присоединяет или отдаёт электроны? Он становится заряженной частицей.
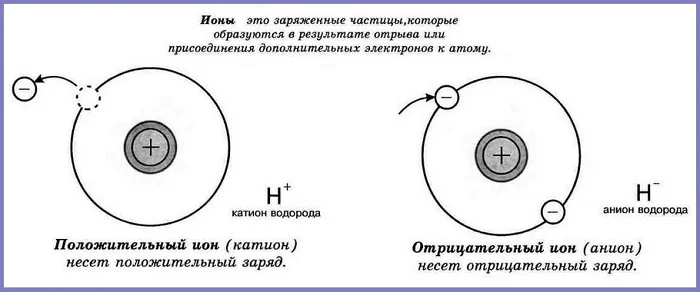
Ионы – частицы, которые положительно или отрицательно заряжены.
Обобщив все вышесказанное, выделим основные постулаты атомно-молекулярного учения, которое является фундаментом в химии, физике и естествознании:
- Вещества состоят из молекул;
- Атомы являются частью молекулы;
- Атомам и молекулам характерно самопроизвольное движение;
- Во время химических реакций происходит изменение состава молекулы и образуются новые вещества.
Методы определения простых веществ и химических элементов
Как узнать, простое ли вещество или химический элемент? Существует несколько методов для определения простого состава вещества или его составляющих элементов. Давайте рассмотрим некоторые из них.
1. Химический анализ
Один из основных методов определения простых веществ и химических элементов — это химический анализ. Составляющие элементы вещества могут быть идентифицированы путем проведения реакций с другими веществами и анализа образовавшихся продуктов. Например, если мы хотим определить, содержит ли вещество кислород, мы можем добавить вещество к водороду и наблюдать, возникнет ли взрыв. Если это произойдет, значит, вещество содержит кислород.
2. Спектральный анализ
Еще один метод определения простых веществ и химических элементов — это спектральный анализ. Этот метод основан на изучении спектра электромагнитных волн, излучаемых или поглощаемых веществом. Каждый химический элемент имеет свой уникальный спектральный отпечаток, который можно использовать для его идентификации. С помощью спектрального анализа мы можем узнать, какие элементы присутствуют в веществе и в каком количестве.
3. Физические свойства
Также физические свойства вещества могут быть использованы для определения его состава. Например, плотность, температура плавления и кипения, электропроводность и другие характеристики могут дать нам подсказку о присутствии определенных элементов или соединений в веществе.
4. Методы спектрометрии
Спектрометрия — это метод, использующийся для изучения внутренней структуры вещества и определения его состава. Ультрафиолетовая, видимая и инфракрасная спектроскопия позволяют анализировать поглощение или излучение электромагнитных волн различных длин волн веществом. Эти методы могут помочь определить присутствие и концентрацию различных элементов и соединений в веществе.
5. Использование химических реакций
Некоторые простые вещества и химические элементы могут быть определены путем проведения специальных химических реакций. Например, если мы хотим определить присутствие алюминия, мы можем добавить к веществу небольшое количество кислоты и наблюдать, возникнет ли выделение газа. Если газ будет выделяться, значит, вещество содержит алюминий.
6. Образец вещества
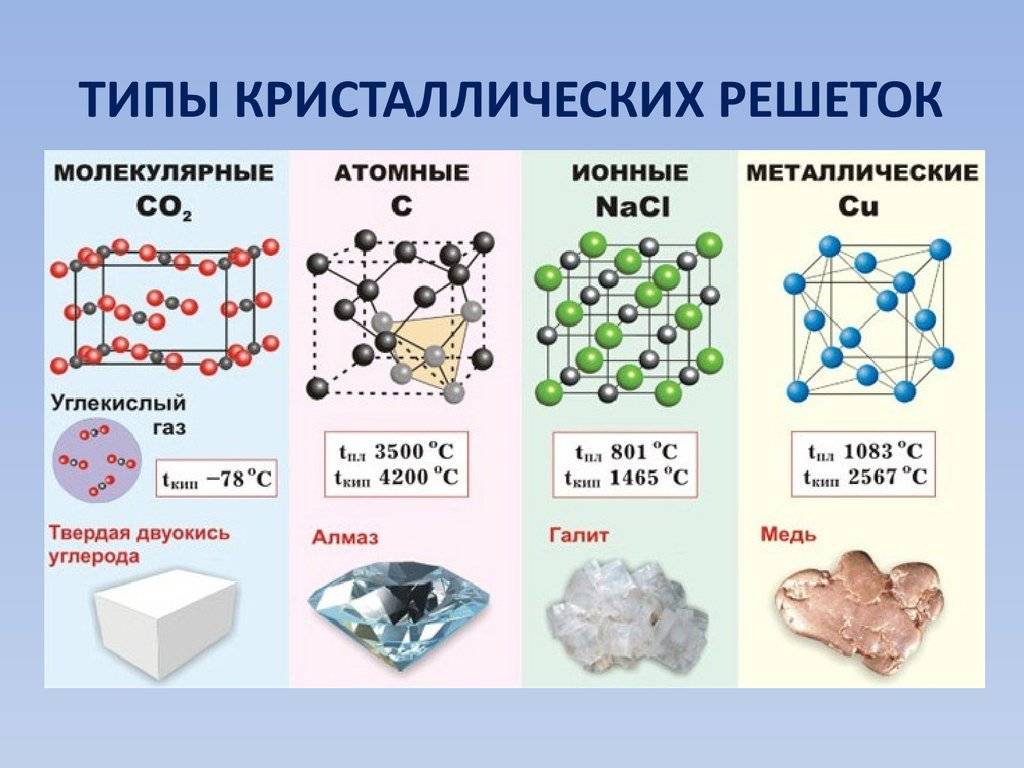
Для определения состава вещества иногда можно использовать микроскопический анализ образца. Определенные элементы и соединения могут иметь уникальную структуру или форму, которые могут быть видны под микроскопом. Например, кристаллическая решетка может указывать на присутствие определенного элемента или соединения в веществе.
Итак, с помощью химического анализа, спектрального анализа, методов спектрометрии, исследования физических свойств вещества, использования химических реакций и образца вещества мы можем определить простые вещества и химические элементы. Каждый из этих методов имеет свои преимущества и ограничения, и, часто, комбинация нескольких методов может дать более точные и надежные результаты.
Свойства химического элемента
Химические элементы имеют ряд уникальных свойств, которые определяют их поведение и взаимодействие с другими веществами.
Один из основных параметров, характеризующих элемент, — это атомная масса, которая определяет его массу в атомах. Атомная масса указывается в таблице химических элементов и позволяет сравнивать массу атомов разных элементов.
Другим свойством является атомный номер, который определяет положение элемента в таблице. Атомный номер также указывает на количество протонов в ядре атома, что определяет его химические свойства и положение в периодической системе.
Важным свойством элементов является их химическая активность. Некоторые элементы обладают высокой активностью и легко вступают в химические реакции с другими веществами, а некоторые элементы наоборот, практически не реактивны.
Также каждый элемент имеет специфическую электронную конфигурацию, которая определяет расположение электронов в атомных оболочках. Электронная конфигурация влияет на химические свойства элемента и его способность вступать в химические реакции.
Большинство элементов имеют различные изотопы, которые отличаются по числу нейтронов в ядре. Изотопы элементов имеют различные физические и химические свойства, что позволяет использовать их в различных научных и промышленных целях.
| Свойство | Описание |
|---|---|
| Атомная масса | Масса атома элемента, определяющая его относительную массу в атомах. |
| Атомный номер | Число протонов в ядре атома элемента, определяющее его положение в таблице химических элементов. |
| Химическая активность | Способность элемента вступать в химические реакции с другими веществами. |
| Электронная конфигурация | Расположение электронов в атомных оболочках элемента, определяющая его химические свойства. |
| Изотопы | Различные версии элемента с разным числом нейтронов в ядре, имеющие различные физические и химические свойства. |
Вопросы и задания
- Выберите правильное окончание утверждения: формульная единица сульфата индия In2(SO4)3 содержит…
- 5 химических элементов;
- 3 химических элемента;
- 3 атома.
- В каком из высказываний речь идет о химическом элементе, а в каком – о простом веществе?
- калий входит в состав поташа;
- калий – мягкий серебристо-белый металл.
- Выберите правильное окончание утверждения: к простым веществам относится…
- негашеная известь;
- озон;
- аммиак.
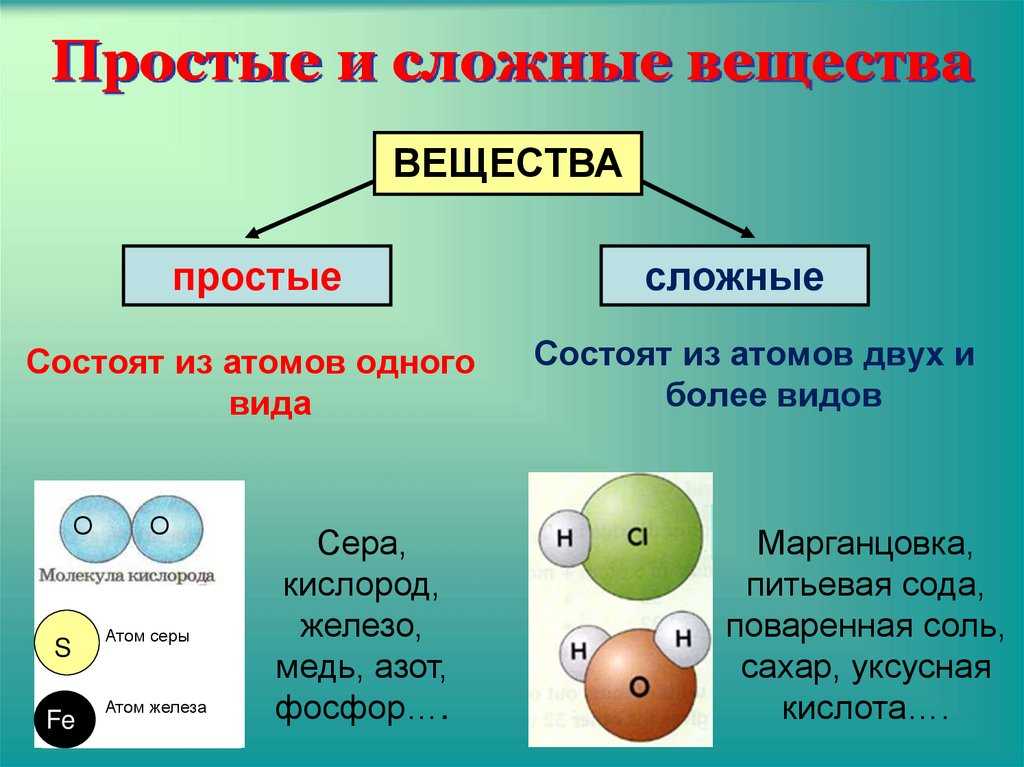
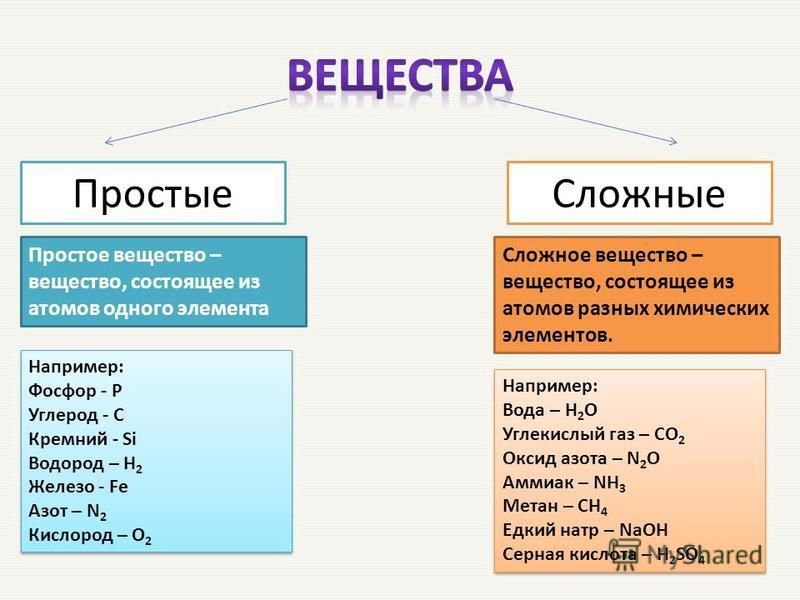
- Составьте из предложенного перечня три списка: а) химические элементы; б) простые вещества; в) сложные вещества.
графит, вода, метан, углерод, красный фосфор.
- Напишите формулу вещества, молекула которого содержит атомы углерода и кислорода в соотношении 1:2. К какому классу соединений оно относится?
- соли;
- кислотные оксиды;
- основные оксиды.
- Определите вещество, которое образуется в реакции соединений SO3 и H2O. Классифицируйте его, выбрав вариант из списка:
- щелочь;
- соль;
- кислота.
- Заполните пропуски:
- сульфат натрия Na2SO4 – соль … кислоты;
- ZnOH — … гидроксид;
- основание …OH – продукт реакции … оксида Li2O с водой.
Ответы
- б).
- а) химический элемент; б) простое вещество.
- б) озон.
- а) углерод; б) графит, красный фосфор; в) вода, метан.
- Химическая формула – CO2, класс – б) кислотный оксид.
- Серная кислота H2SO4, вариант б).
а) сульфат натрия Na2SO4 – соль серной кислоты; б) ZnOH – амфотерный гидроксид; в) основание LiOH – продукт реакции основного оксида Li2O с водой.
Атомная масса
Атомная масса является средним значением массы атомов всех изотопов данного элемента, учитывая их относительное распространение на Земле. Это связано с тем, что атомы элементов могут иметь различное количество нейтронов в своем ядре, что приводит к различным изотопам.
Таким образом, атомная масса — это среднее арифметическое всех изотопов элемента, взвешенное по их процентному содержанию.
Для учета различий в атомных массах элементов, принято использовать отдельную единицу массы — атомную единицу массы (а.е.м.). Она определена как 1/12 массы атома углерода-12. Таким образом, атом углерода-12 имеет атомную массу, приравненную к 12 а.е.м. Атомная масса других элементов выражается относительно этого стандарта.
Атомные массы элементов приведены в периодической таблице химических элементов. Они позволяют сравнивать массу атомов различных элементов и использовать ее для расчета количества вещества в химических реакциях.
Примеры атомных масс некоторых элементов
Элемент
Атомная масса (а.е.м.)
Водород
1
Углерод
12
Кислород
16
Железо
56
Золото
197
Связь атомной массы и молярной массы
Атомная масса элемента выражается в атомных единицах массы, а молярная масса — это масса одного моля данного вещества. Молярная масса выражается в г/моль и равна числовому значению атомной массы данного элемента.
Например, атомная масса кислорода равна 16 а.е.м., а его молярная масса равна 16 г/моль. То есть, одна моль кислорода содержит 6,022 × 10^23 атомов, массой в 16 г.
Что такое химический элемент?
Химическим элементом называют определенный вид атомов. В настоящее время известно 118 химических элементов. Каждый элемент обозначают символом, который представляет одну или две буквы из его латинского названия. Например, элемент водород обозначают латинской буквой H и формулой H2 – первой буквой латинского названия элемента Hydrogenium. Все достаточно хорошо изученные элементы имеют символы и названия, которые можно найти в главных и побочных подгруппах Периодической системы, где все они расположены в определенном порядке.
Cуществует много видов систем, но общепринятой является Периодическая система химических элементов Д. И. Менделеева, которая является графическим выражением Периодического закона Д. И. Менделеева. Обычно используют короткую и длинную формы Периодической системы.
Рис. 2. Периодическая система элементов Д. И. Менделеева.
Что же является главным признаком, по которому атом относят к определенному элементу? Д. И. Менделеев и другие ученые-химики XIX века считали главным признаком атома массу как наиболее стабильную его характеристику, поэтому элементы в Периодической системе расположены в порядке возрастания атомной массы (за немногим исключением).
По современным представлениям, главным свойством атома, относящим его к определенному элементу, является заряд ядра. Таким образом, химический элемент – это вид атомов, характеризующихся определенным значением (величиной) части химического элемента – положительного заряда ядра.
Из всех существующих 118 химических элементов большую часть (около 90) можно обнаружить в природе. Остальные же получены искусственно с помощью ядерных реакций. Элементы 104-107 были синтезированы учеными-физиками в Объединенном институте ядерных исследований в городе Дубне. В настоящее время продолжаются работы по искусственному получению химических элементов с более высокими порядковыми номерами.
Все элементы делятся на металлы и неметаллы. Более 80 элементов относятся к металлам. Однако это деление условное. При определенных условиях некоторые металлы могут проявлять неметаллические свойства, а некоторые неметаллы – металлические свойства.
Содержание различных элементов в природных объектах колеблется в широких пределах. 8 химических элементов (кислород, кремний, алюминий, железо, кальций, натрий, калий, магний) составляют 99% земной коры по массе, все остальные – менее 1%. Большинство химических элементов имеют природное происхождение (95), хотя некоторые из них изначально были выведены искусственно (например, прометий).
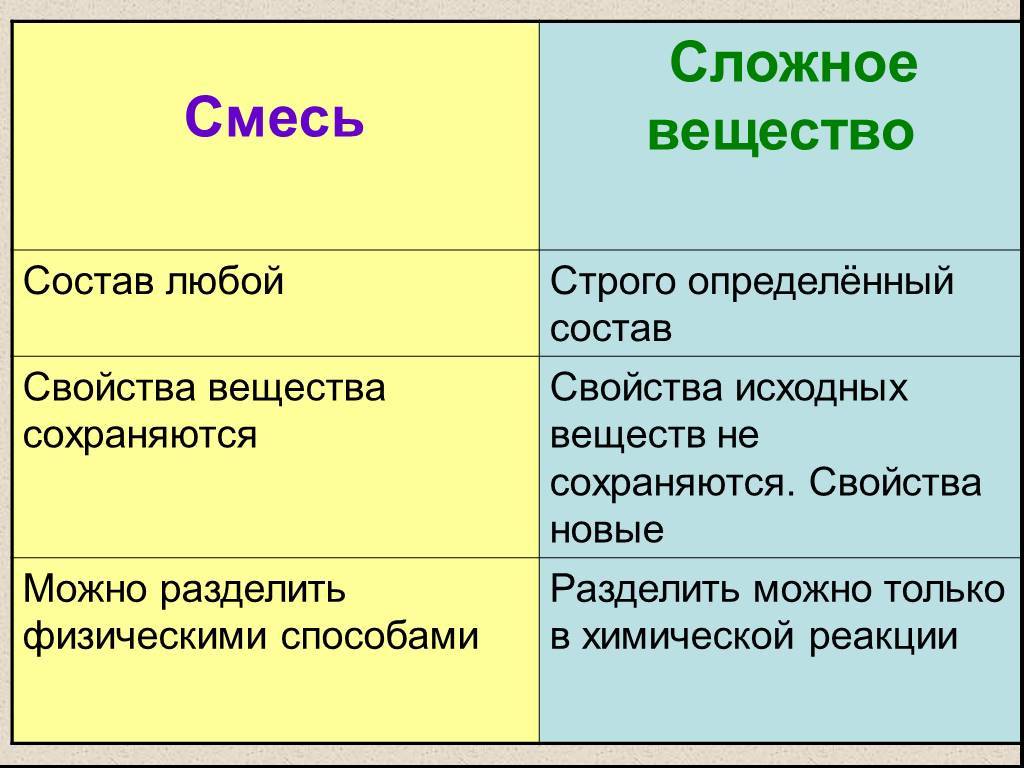
Следует различать понятия «простое вещество» и «химический элемент». Простое вещество характеризуется определенными химическими и физическими свойствами. В процессе химического превращения простое вещество утрачивает часть своих свойств и входит в новое вещество в виде элемента. Например, азот и водород, входящие в состав аммиака, содержатся в нем не в виде простых веществ, а в виде элементов.
Некоторые элементы объединяются в группы, такие как органогены (углерод, кислород, водород, азот), щелочные металлы (литий, натрий, калий и т.д.), лантаноиды (лантан, церий и т.д.), галогены (фтор, хлор, бром и т.д.), инертные элементы (гелий, неон, аргон)
Рис. 3. Галогены таблица.
Что мы узнали?
При введении в курс химии 8 класса в первую очередь необходимо изучить понятие «химический элемент». в настоящее время известно 118 химических элементов, расположенных в таблице Д. И. Менделеева согласно возрастанию атомной массы, и имеющих основно-кислотные свойства.
/10
Вопрос 1 из 10
Структура ОГЭ по химии
Первая часть экзамена состоит из 30 тестовых заданий, каждое из которых имеет один правильный ответ. Эти задания основаны на знаниях учащихся по теории и законам химии, а также на их практических навыках и умении решать химические задачи. Учащимся предлагается выбрать правильный ответ из нескольких предложенных вариантов.
Во второй части экзамена учащимся предлагается выполнить краткое изложение по предложенной теме. Темы для изложений связаны с основами химии и требуют от учащихся умения выразить свои мысли и идеи в письменной форме. Здесь важным аспектом является ясность и последовательность изложения мыслей.
Третья часть экзамена состоит из практических заданий, которые требуют от учащихся навыков проведения химических экспериментов и определения различных веществ. Учащимся предлагается выполнить конкретные химические операции, такие как разведение растворов, измерение объема газов, проведение простых химических реакций и интерпретацию полученных результатов.
Четвертая часть: Контрольные задания
Четвертая часть экзамена содержит контрольные задания, которые проверяют понимание и усвоение основных понятий и законов химии. Эти задания требуют от учащихся решения конкретных химических задач на основе предоставленной информации
Здесь важно правильно применить полученные знания для решения задач и объяснения явлений в химических процессах.
Структура ОГЭ по химии позволяет оценить знания учащихся в различных аспектах химии и выявить их уровень подготовки. Экзамен проверяет как теоретические знания, так и практические навыки, что позволяет оценить полноценное понимание предмета и его применение в реальных ситуациях. Успешное прохождение ОГЭ по химии является одним из ключевых критериев для дальнейшего обучения в области химических наук.
Химические элементы и их соединения
Совокупность атомов с одинаковой величиной заряда ядра называют химическим элементом. Эта величина в периодической таблице представлена порядковым номером элемента. Например, номер азота – 7 – означает, что в ядре атома азота 7 протонов.
У химических элементов существуют разновидности – изотопы, отличающиеся числом нейтронов в ядре и значениями атомных масс. Физические свойства изотопов неодинаковы, а химические идентичны, поскольку они представляют один и тот же элемент.
Число внешних электронов в атоме может изменяться. В этом случае он приобретает электрический заряд и становится ионом: отрицательным, если присоединяет лишний электрон, и положительным при потере своего. При этом не происходит превращения одного химического элемента в другой, так как заряд ядра сохраняется.
Соединения. Химические формулы
Атомы вступают в химическую связь, взаимодействуя внешними электронными оболочками, и образуют молекулы или немолекулярные структуры с регулярным строением. Вещества, частицы которых представляют собой устойчивые сочетания атомов или ионов, называются химическими соединениями.
Химические обозначения соединений – формулы – отражают элементный состав и количество атомов каждого элемента в структурной единице вещества. Формула H2 означает, что молекула вещества образована одним элементом и состоит из двух атомов. По формуле KNO3 видно, что вещество составлено тремя элементами – калием, азотом и кислородом в соотношении 1:1:3.
Физические свойства
Физические свойства химического элемента включают в себя такие характеристики, как плотность, температура плавления и кипения, теплоемкость, теплопроводность, электропроводность и прочие параметры, связанные с его состоянием и способностью взаимодействовать с другими веществами.
Плотность
Плотность элемента — это масса единицы объема этого вещества. Она является физической характеристикой, которая может изменяться при изменении условий (например, температуры и давления). Плотность может быть выражена в различных единицах измерения, таких как г/см³ или кг/м³.
Температура плавления и кипения
Температура плавления — это температура, при которой химический элемент переходит из твердого состояния в жидкое состояние. Температура кипения — это температура, при которой элемент переходит из жидкого состояния в газообразное состояние. Температуры плавления и кипения могут быть различными для разных элементов и являются важными характеристиками, которые указывают на изменение состояния элемента при изменении температуры.
Важно отметить, что значения температуры плавления и кипения могут быть указаны для элементов при стандартных условиях (например, 0°C и 1 атмосфере давления), но могут также изменяться при изменении давления и других факторов
Теплоемкость, теплопроводность и электропроводность
Теплоемкость элемента — это количество теплоты, которое необходимо передать элементу для изменения его температуры на определенное количество градусов. Теплопроводность — это способность элемента проводить тепло. Электропроводность — это способность элемента проводить электрический ток.
Эти свойства могут быть различными для разных элементов и могут зависеть от их структуры и состава. Например, металлы обычно обладают высокой теплопроводностью и электропроводностью, в то время как неметаллы могут иметь более низкую проводимость.
Физические свойства химического элемента являются важными при изучении его химических и физических свойств, а также при применении элементов в различных областях, таких как промышленность, медицина, электроника и другие.