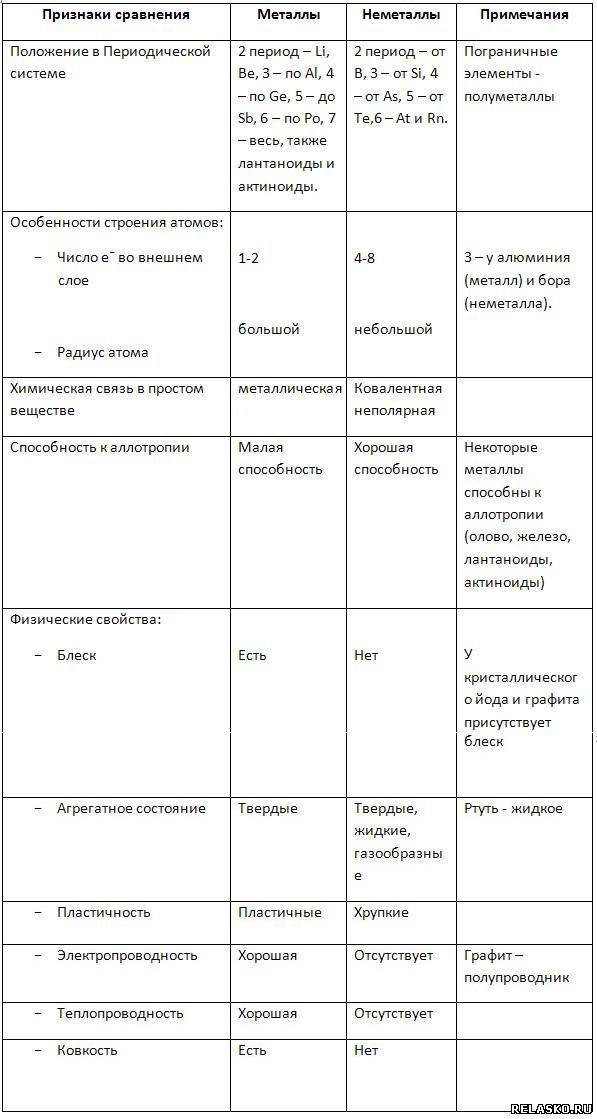
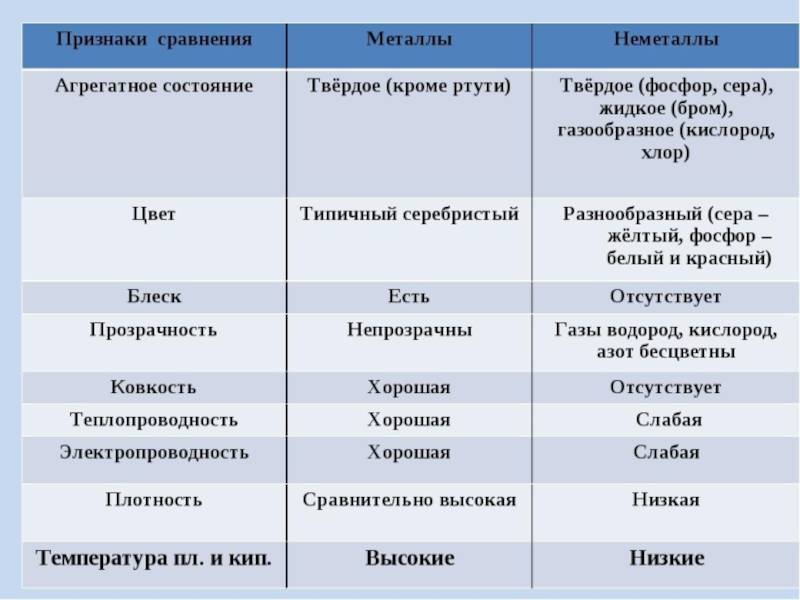
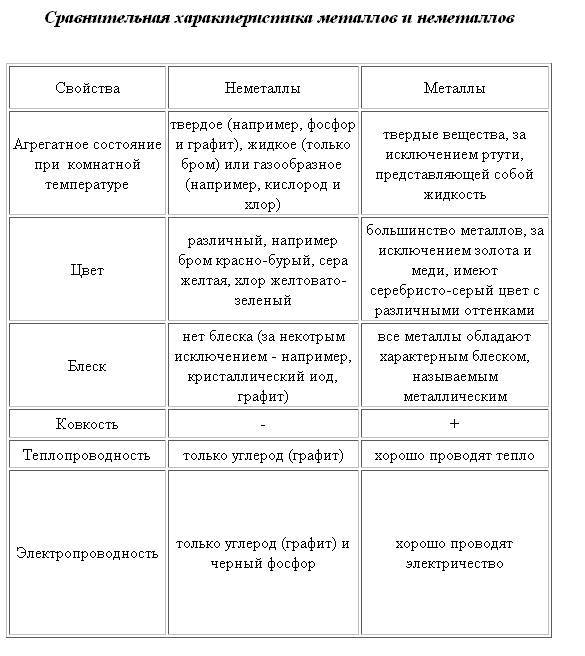
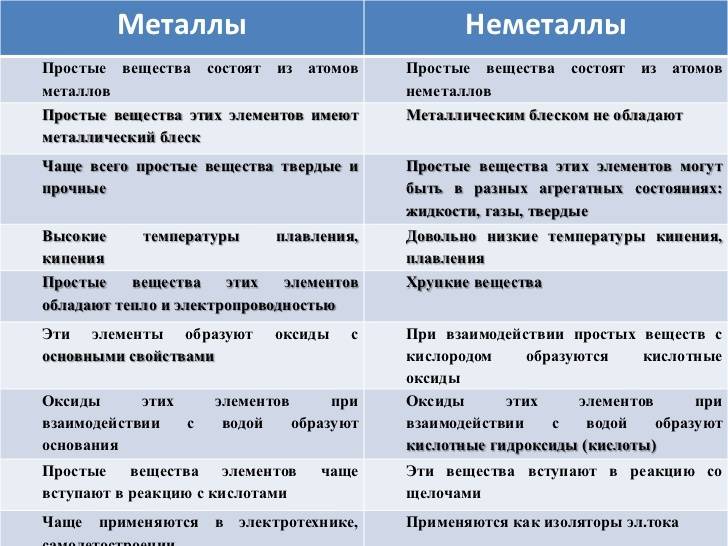
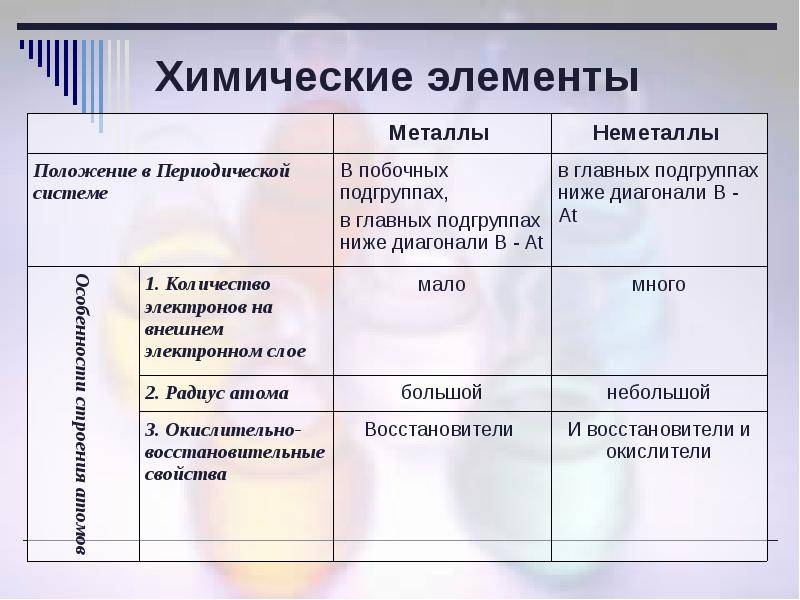
Общие физические свойства
Основные характеристики металлов
Проводимость электричества и тепла. Одной из основных характеристик металлов является их способность проводить электричество и тепло. Металлы обладают свободными электронами, которые легко перемещаются внутри материала, обеспечивая электрическую проводимость. Кроме того, металлы обладают высокой теплопроводностью, что позволяет им быстро распространять и отводить тепло.
Гладкость и блеск поверхности. Одним из характерных свойств металлов является их блестящая поверхность. Металлические поверхности отражают свет, и благодаря этому металлы выглядят гладкими и блестящими. Это свойство делает металлы популярными материалами для создания украшений и декоративных элементов.
Изгибаемость и пластичность. Металлы обладают высокой пластичностью и изгибаемостью, что позволяет им быть легко размещенными в различные формы. Металлы могут быть легко изгибаемы, растягиваемы и прокатываемы, что способствует их широкому применению в промышленности, строительстве и производстве различных изделий.
Высокая плотность. Металлы обладают высокой плотностью, что означает, что их масса на единицу объема является значительной. Это свойство делает металлы тяжелыми, что может быть как полезным, так и недостаточным, в зависимости от конкретного применения.
Высокая температура плавления и кипения. Большинство металлов имеют высокую температуру плавления и кипения. Это позволяет им существовать в твердом состоянии при обычных условиях окружающей среды. Однако, некоторые металлы имеют низкую температуру плавления, что позволяет использовать их для специфических целей, например в пайке и сварке.
Химические свойства металлов и неметаллов
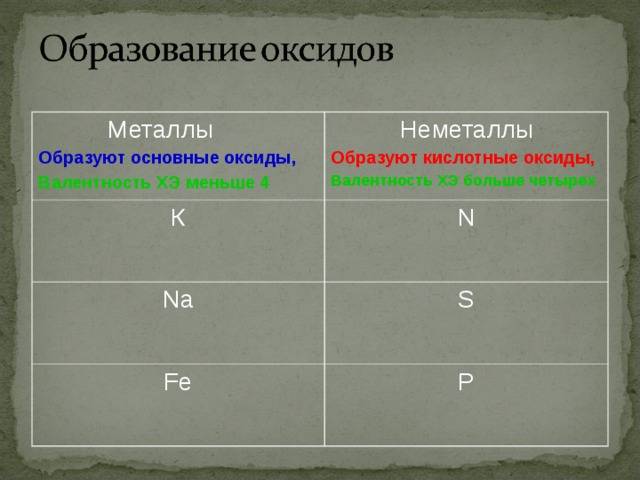
Металлы и неметаллы обладают разными химическими свойствами, которые определяют их поведение в химических реакциях и взаимодействие с другими веществами.
Металлы:
1. Имеют высокую электропроводность.
2. Способны образовывать положительные ионы, отдавая электроны.
3. Обычно обладают металлическим блеском.
4. Хорошо проводят тепло и электричество.
5. Обладают высокой пластичностью и способностью к податливости, что позволяет из них получать различные формы.
6. Обычно образуют ионные соединения с неметаллами.
7. Образуют катионы с положительным зарядом в реакциях с кислородом и другими не металлами.
Неметаллы:
1. Имеют низкую электропроводность или вовсе не проводят электричество.
2. Способны образовывать отрицательные ионы, принимая электроны.
3. В большинстве случаев обладают скученностью или прозрачностью.
4. Плохо проводят тепло и электричество.
5. Хрупкие и не обладают пластичностью.
6. Чаще образуют ковалентные связи.
7. Имеют высокую аффинность к электронам, что способствует образованию анионов в реакциях с металлами.
Химические свойства металлов и неметаллов определяют их важную роль в различных областях, включая промышленность, науку и технологии, что делает их изучение неотъемлемой частью химии.
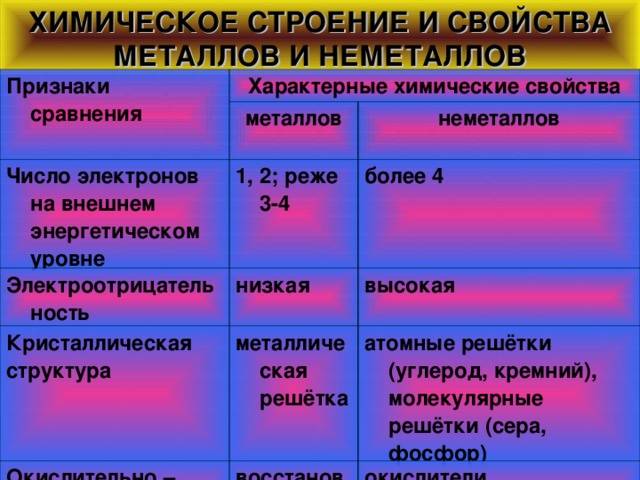
Химические свойства металлов и неметаллов
Металлы представляют собой группу химических элементов, которые проявляют ряд характерных свойств. В отличие от неметаллов, металлы обладают хорошей теплопроводностью и электропроводностью. Они способны образовывать положительные ионы, также известные как катионы. Металлические элементы обычно имеют блестящую поверхность и относительно низкую электроотрицательность.
Металлы легко реагируют с кислородом, образуя оксиды. Этот процесс известен как окисление. Оксиды металлов, такие как оксид железа (III), могут быть использованы в производстве различных материалов, таких как стекло, керамика и сталь. Металлы также могут реагировать с кислотами, образуя соли и выделяя водород.
Неметаллы, с другой стороны, обладают характеристиками, противоположными металлам. Они плохо проводят тепло и электричество. Неметаллы обычно образуют отрицательные ионы, также известные как анионы. Поверхность неметаллических элементов обычно не блестящая и они имеют относительно высокую электроотрицательность.
Неметаллы обычно реагируют с металлами, чтобы образовывать ионные соединения. Водород, хлор и азот являются примерами неметаллов, способных образовывать химические связи с металлами. Неметаллы могут также реагировать с кислотами, образуя соли и выделяя водород. Они могут образовывать ковалентные соединения с другими неметаллами, что приводит к образованию молекул.
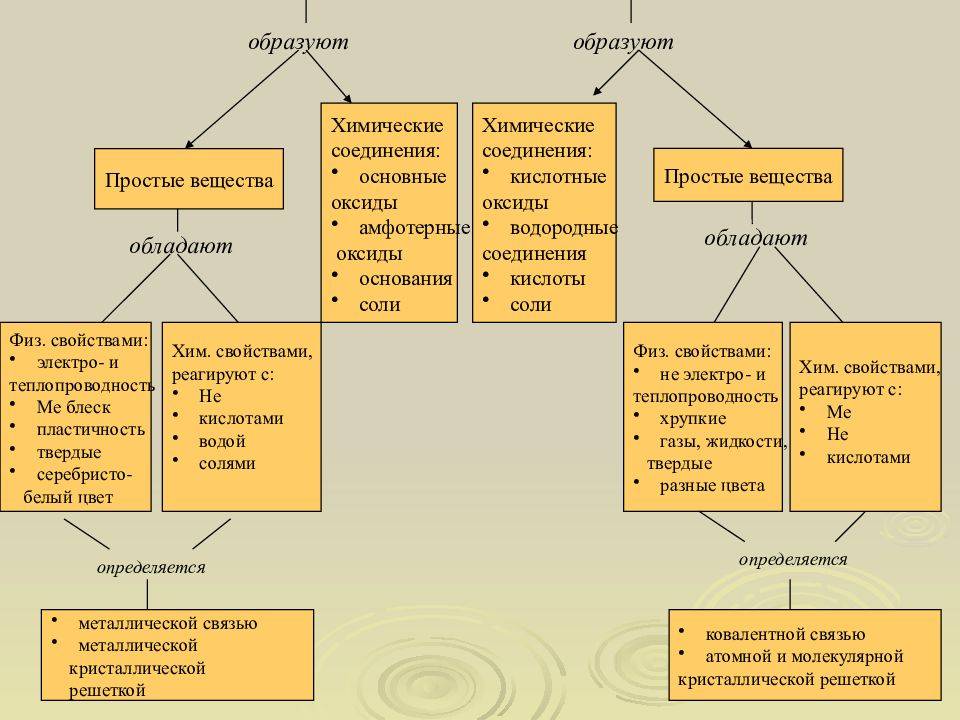
Применение металлов и неметаллов в промышленности и быту
Металлы и неметаллы широко применяются в промышленности и быту благодаря своим уникальным свойствам и характеристикам.
Металлы, такие как железо, алюминий и медь, являются важными материалами в строительстве и производстве механизмов. Они отличаются высокой прочностью, термостойкостью и электропроводностью. Железо используется для создания строительных конструкций, автомобилей, железнодорожных путей и других инфраструктурных объектов. Алюминий широко применяется в авиации, производстве упаковки и бытовой технике благодаря своей легкости и высокой коррозионной стойкости. Медь используется в электротехнике, в частности для создания проводов, из-за своей высокой электропроводности.
Неметаллы, такие как углерод, кремний и сера, также имеют широкий спектр применений. Углерод используется в производстве стали, пластмасс, резины и других материалов. Его применение обусловлено способностью образовывать жесткую и прочную структуру. Кремний используется в производстве полупроводников, стекла и керамики из-за своих полупроводниковых свойств. Он является ключевым элементом в электронике и солнечных батареях. Сера применяется в производстве противоракетных ракет, резиновых изделий и косметических товаров.
В быту металлы и неметаллы находят применение в различных предметах и изделиях. Металлические посуда, столовые приборы, мебель, дверные ручки и лампы часто изготавливаются из алюминия, стали или латуни. Некоторые неметаллические материалы, такие как стекло, пластик и резина, используются для изготовления посуды, упаковки и гигиенических товаров.
| Применение металлов | Применение неметаллов |
|---|---|
| Строительство | Производство пластмасс |
| Автомобильная промышленность | Производство стекла |
| Авиация | Производство резины |
| Электротехника | Производство керамики |
| Мебельное производство | Производство полупроводников |
Применение металлов и неметаллов в промышленности и быту является неотъемлемой частью современного общества. Благодаря их уникальным свойствам, мы можем создавать и использовать различные материалы и изделия, которые улучшают нашу жизнь и облегчают нашу работу.
Отличия металлов от неметаллов
Металлы обладают низкой электроотрицательностью, что делает их способными отдавать электроны и образовывать положительно заряженные ионы. Они обычно являются ковкими, тугоплавкими и хорошо проводящими тепло и электричество. Как правило, металлы имеют блестящую поверхность и образуют положительные ионы при образовании химических связей. Некоторые известные металлы включают железо, алюминий, медь и олово.
Неметаллы имеют высокую электроотрицательность и обычно принимают электроны, образуя отрицательно заряженные ионы. Они обычно хрупкие, непроводящие тепло и электричество и имеют меньшую плотность по сравнению с металлами. В отличие от металлов, неметаллы могут быть газообразными, жидкими или твердыми при комнатной температуре. К неметаллам относятся кислород, углерод, нитроген и хлор.
Важно отметить, что существуют элементы, которые обладают промежуточными свойствами между металлами и неметаллами, и называются полуметаллами или металлоидами. Они имеют свойства и характеристики как металлов, так и неметаллов
Проводимость электричества и тепла
Проводимость электричества у металлов основана на свободных электронах, которые могут передвигаться по кристаллической решетке металла. Это позволяет электронам свободно двигаться и нести электрический заряд. Неметаллы обычно не имеют подобной свободной электронной структуры, поэтому они не могут эффективно проводить электричество.
Теплопроводность в металлах также основана на свободных электронах. При повышении температуры электроны получают дополнительную энергию и начинают более активно двигаться. Это позволяет энергии быстро передаваться от одного электрона к другому, что способствует высокой теплопроводности металлов. В неметаллах теплопроводность обычно ниже, так как электроны могут быть связаны с атомами и иметь более ограниченные пути передвижения.
Наличие высокой проводимости электричества и тепла делает металлы важными материалами для различных технических применений, включая провода, электрические контакты и радиаторы. Неметаллы, обладающие низкой проводимостью, также находят свое применение в других отраслях, например, в изоляционных материалах и теплоизоляции.
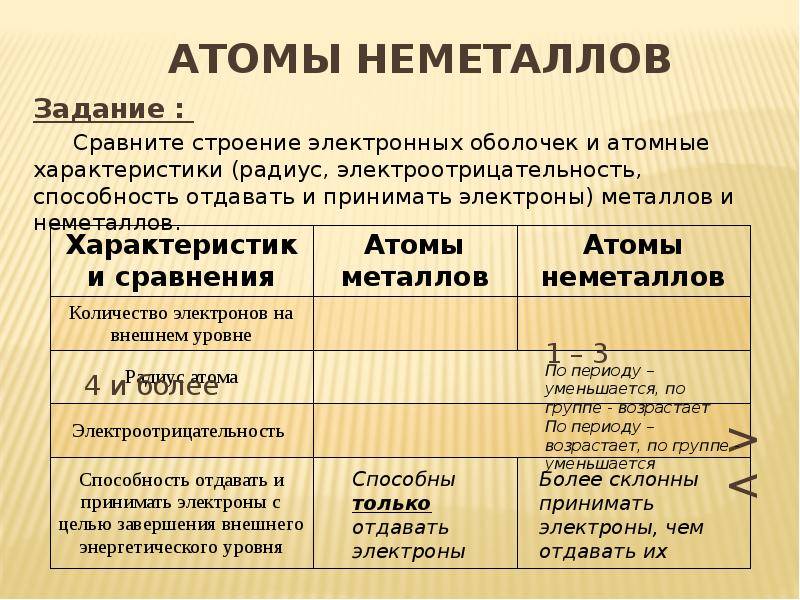
Электроотрицательность
Металлы характеризуются низкой электроотрицательностью, что означает, что они имеют слабую способность притягивать электроны. Это объясняется строением электронной оболочки металлов, которая имеет малое количество электронов валентной оболочки и большое количество электронов внутренних оболочек. Из-за этого металлы легко отдают электроны и образуют положительные ионы.
Неметаллы, напротив, обладают высокой электроотрицательностью. У них большее количество электронов валентной оболочки и меньшее количество электронов внутренних оболочек. Неметаллы имеют сильную способность притягивать электроны, что позволяет им образовывать отрицательные ионы.
Электроотрицательность характеризуется числовыми значениями, которые указывают на относительную способность атома притягивать электроны. Существует шкала электроотрицательности, разработанная Линусом Полингом, где каждому элементу химического периодического стола присваивается определенное значение. Наиболее электроотрицательным элементом является флуор (F), а наименее электроотрицательным — франций (Fr).
Электроотрицательность важна для определения типа химической связи, образующейся между атомами. Если разность электроотрицательностей атомов превышает определенное значение, то образуется несимметричная химическая связь, называемая полярной ковалентной связью. В случае, когда разность электроотрицательностей невелика или отсутствует, связь называется неполярной ковалентной связью.
| Группа | Металлы | Неметаллы |
|---|---|---|
| 1 | Литий (Li) | Водород (H) |
| 2 | Бериллий (Be) | Бор (B) |
| 3 | Натрий (Na) | Углерод (C) |
| 4 | Магний (Mg) | Азот (N) |
| 5 | Алюминий (Al) | Кислород (O) |
| 6 | Цинк (Zn) | Фтор (F) |
| 7 | Железо (Fe) | Хлор (Cl) |
Свойства неметаллов
У них почти все наоборот:
- Ковать нельзя, потому что они хрупкие.
- Не обладают металлическим блеском.
- Не проводят электрический ток (за редким исключением – кремний и графит могут быть проводниками).
- Очень плохо проводят тепло.
- Есть твердые, газообразные, жидкие.
Неметаллов на данный момент 22.
Это первая статья по химии на нашем сайте. Напишите, что не так, что нравится и не нравится. Я буду думать, как сделать материал лучше.
И еще – есть идея записывать видеоролики с объяснениями. Лично вам удобнее разбираться в чем-то, читая текст, или просматривая видео?
Буду рад каждому вашему отзыву и комментарию.
Основные различия между металлами и неметаллами
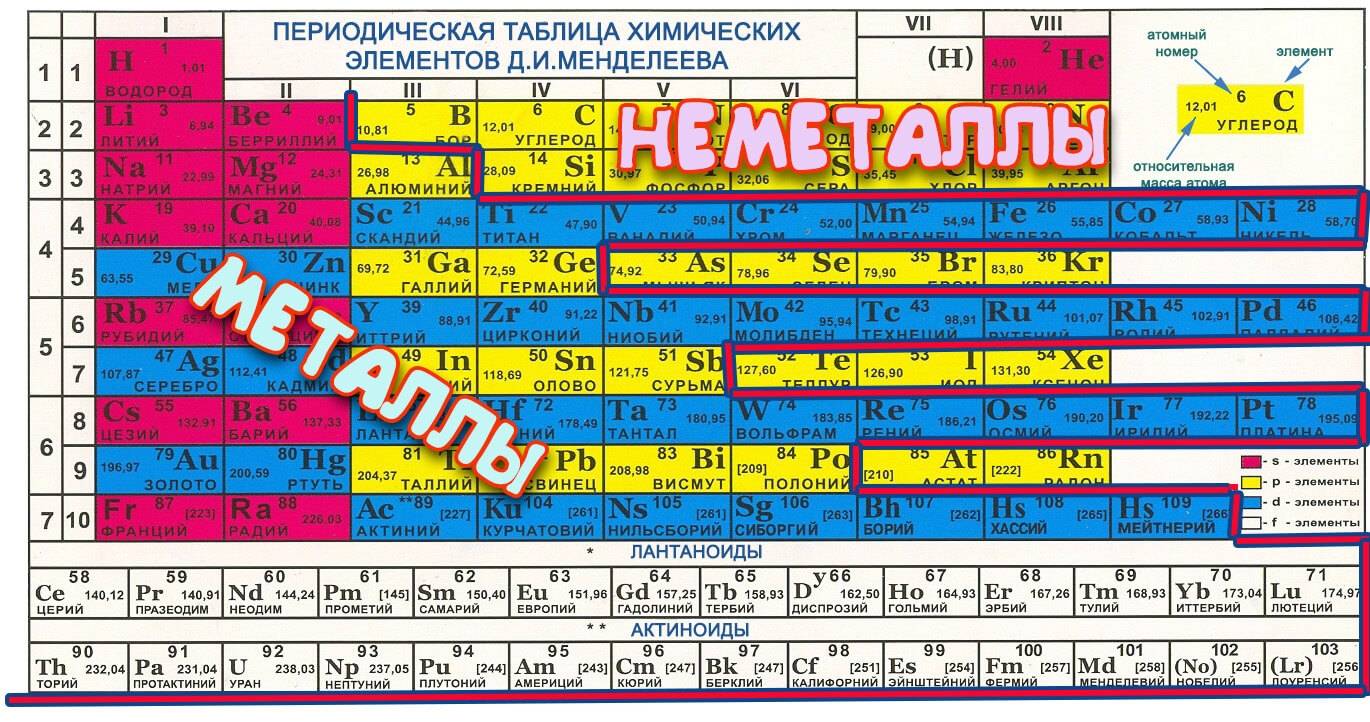
Металлы в таблице Менделеева
В системе Менделеева сплавы имеют преобладающее число и список их весьма велик – они начинаются с Бора (В) и заканчиваются полонием (Po) (исключением являются германий (Ge) и сурьма (Sb)). У этой группы есть характерные признаки, они разделены на группы, но их свойства при этом неоднородны. Характерные их признаки:
- пластичность,
- электропроводимость,
- блеск,
- легкая отдача электронов,
- ковкость,
- теплопроводность,
- твердость (кроме ртути).
Из-за различной химической и физической сути свойства могут существенно отличаться у двух представителей этой группы, не все они похожи на типичные природные сплавы, к примеру, ртуть – это жидкая субстанция, но относится к данной группе.
В обычном своем состоянии она жидкая и без кристаллической решетки, которая играет ключевую роль в сплавах. Только химические характеристики роднят ртуть с данной группой элементов, несмотря на условность свойств этих органических соединений. То же самое касается и цезия – самого мягкого сплава, но он не может в природе существовать в чистом виде.
Некоторые элементы такого типа могут существовать только доли секунды, а некоторые не встречаются в природе совсем – их создали в искусственных условиях лаборатории. У каждой из групп металлов в системе есть свое название и признаки, которые отличают их от других групп.
При этом отличия у них весьма существенные. В периодической системе все металлы располагаются по количеству электронов в ядре, т.е. по увеличению атомной массы. При этом для них характерно периодическое изменение характерных свойств. Из-за этого в таблице они не размещаются аккуратно, а могут стоять неправильно.
В первой группе щелочей нет веществ, которые бы встречались в чистом виде в природе – они могут пребывать только в составе различных соединений.
Как отличить металл от неметалла?
Как определить металл в соединении? Существует простой способ определения, но для этого необходимо иметь линейку и таблицу Менделеева. Для определения надо:
- Провести условную линию по местам соединения элементов от Бора до Полония (можно до Астата).
- Все материалы, которые будут слева линии и в побочных подгруппах – металл.
- Вещества справа – другого типа.
Однако у способа есть изъян – он не включает в группу Германий и Сурьму и работает только в длинной таблице. Метод можно использовать в качестве шпаргалки, но чтобы точно определить вещество, следует запомнить список всех неметаллов. Сколько их всего? Мало – всего 22 вещества.
В любом случае, для определения природы вещества необходимо рассматривать его в отдельности. Легко будет элементы, если знать их свойства
Важно запомнить, что все металлы:
- При комнатной температуре – твердые, за исключением ртути. При этом они блестят и хорошо проводят электрический ток.
- У них на внешнем уровне ядра меньшее количество атомов.
- Состоят из кристаллической решетки (кроме ртути), а все другие элементы имеют молекулярную или ионную структуру.
- В периодической системе все неметаллы – красного цвета, металлы – черного и зеленого.
- Если двигаться слева направо в периоде, то заряд ядра вещества будет увеличиваться.
- У некоторых веществ свойства выражены слабо, но они все равно имеют характерные признаки. Такие элементы относятся к полуметаллам, например Полоний или Сурьма, они обычно располагаются на границе двух групп.
Важно запомнить, что при перемещении в таблице сверху вниз становятся сильнее неметаллические свойства веществ, поскольку там располагаются элементы, которые имеют отдаленные внешние оболочки. Их ядро отделено от электронов и поэтому они притягиваются слабее
Почему неметаллические свойства слабеют «сверху вниз»
Идем дальше. Период в таблице показывает количество уровней (тех самых орбит), по которым летают электроны.
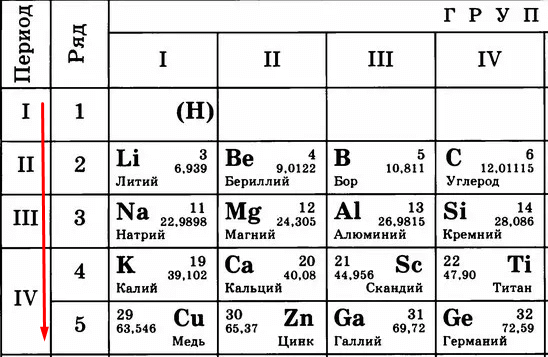
Чем больше период, тем больше этих орбит и тем дальше оказываются электроны от ядра. Сравните:
Кому сложнее удерживать электроны на последнем уровне? Меди, конечно, потому что эти электроны в два раза дальше от ядра, чем, например, у лития. Их проще становится отдать, чем пытаться удерживать.
Следовательно, «сверху вниз» количество уровней, по которым движутся электроны, растет, удерживать их становится сложнее, поэтому металлические свойства усиливаются, а неметаллические – слабеют.
Да, заряд атома тоже растет, но все-таки расстояние перевешивает. Чем больше уровней, тем труднее становится держать электроны, даже несмотря на то, что заряд увеличивается.
Обобщаю:
- Слева направо в таблице металлические свойства слабеют, неметаллические усиливаются из-за того, что ядро сильнее тянет к себе электроны.
- Сверху вниз металлические свойства усиливаются, неметаллические слабеют, потому что уровней становится больше, и удерживать электроны на последних уровнях становится труднее.
Из этих двух положений следует, что в правом углу таблицы Менделеева будут сосредоточены неметаллы, а в левом – металлы.
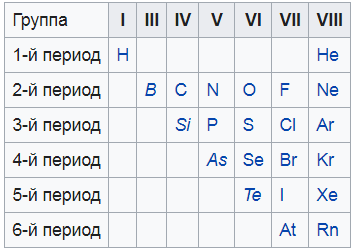
Я нашел вам вот такую картинку, на ней показаны все неметаллы. То, что выделено курсивом – это так называемые металлоиды – вроде и не совсем металлы, и в то же время не неметаллы. Нечто среднее.
Характеристики металлов
| Свойство | Описание |
|---|---|
| Проводимость электричества | Металлы являются отличными проводниками электричества. У них свободно перемещаются электроны, что позволяет им легко передавать электрический ток. |
| Проводимость тепла | Металлы также обладают высокой проводимостью тепла. Это означает, что они хорошо передают тепло, что широко используется в промышленности и бытовых приборах. |
| Пластичность | Металлы могут быть легко обработаны, изгибаться и формироваться без разрушения. Они обладают пластичностью, что делает их идеальными для различных процессов обработки. |
| Металлический блеск | Металлы имеют характерный металлический блеск, который обусловлен отражением света от их поверхности. Это делает их эстетически привлекательными и полезными в ювелирном искусстве. |
| Высокая прочность | Металлы обладают высокой прочностью и способностью переносить большие нагрузки без деформации или разрушения. Это свойство делает их важными материалами для строительства и машиностроения. |
| Химическая реактивность | Металлы могут образовывать соли и проявлять реакции с другими веществами. Некоторые металлы, такие как железо, могут окисляться и ржаветь при контакте с влагой и кислородом. |
| Магнитные свойства | Некоторые металлы, такие как железо, никель и кобальт, обладают магнитными свойствами. Они могут притягиваться к магнитному полю и использоваться в производстве постоянных магнитов. |
Эти характеристики делают металлы полезными и широко применяемыми материалами в различных отраслях промышленности, технологии и повседневной жизни.
Физические свойства неметаллов
Неметаллы – химические элементы, атомы которых стремятся принять чужие электроны. Для них характерны атомные и молекулярные кристаллические решетки. Для атомов неметаллов не характерны общие физические свойства. На данный момент существует 22 неметалла.

Для неметаллов характерен ряд свойств:
- хрупкость (неметаллы нельзя ковать);
- отсутствие блеска;
- непроводимость электрического тока и тепла.
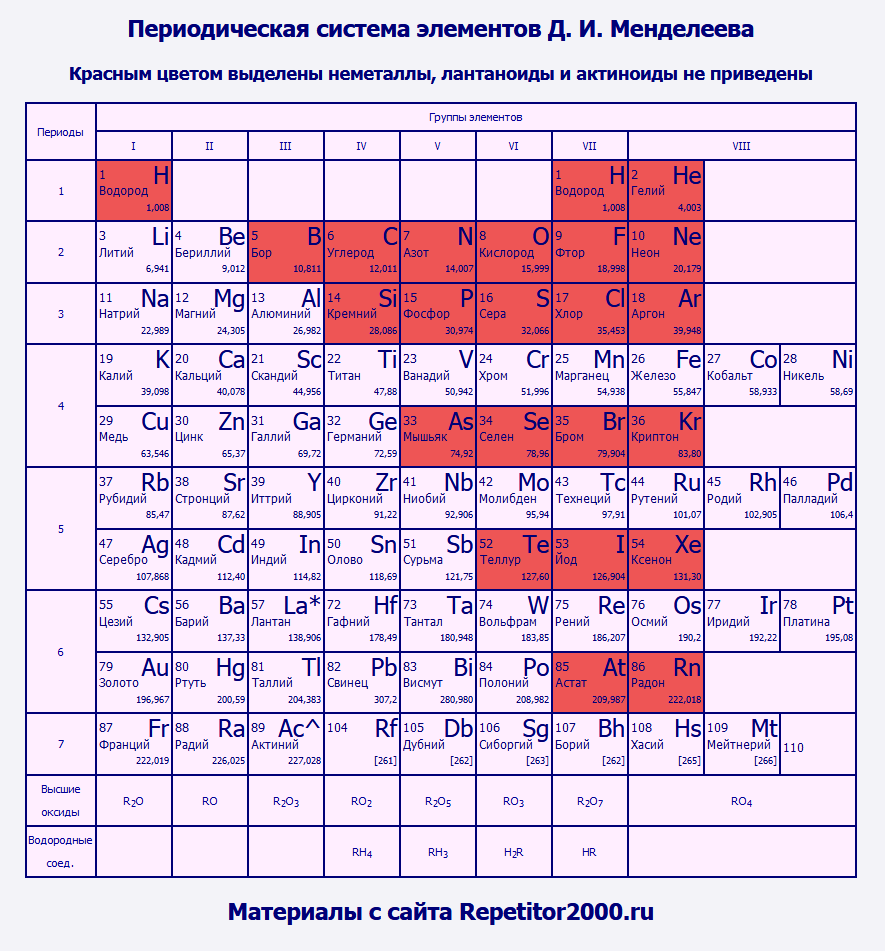
Расположение металлов и неметаллов в периодической таблице Д.И. Менделеева
Определить, является простое вещество металлом или неметаллом, можно с помощью периодической таблицы Менделеева. Металлы располагаются ниже диагонали «водород-бор- кремний-мышьяк-теллур-астат», а неметаллы выше.
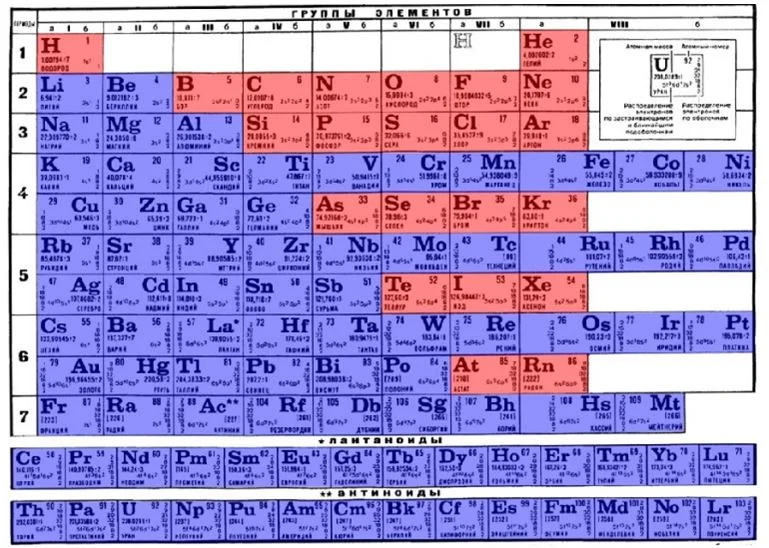
Красные ячейки – неметаллы, синие – металлы
Элементы, расположенные вблизи диагонали, обладают смешанными свойствами: проявляют как металлические, так и неметаллические свойства. Они называются полуметаллами.
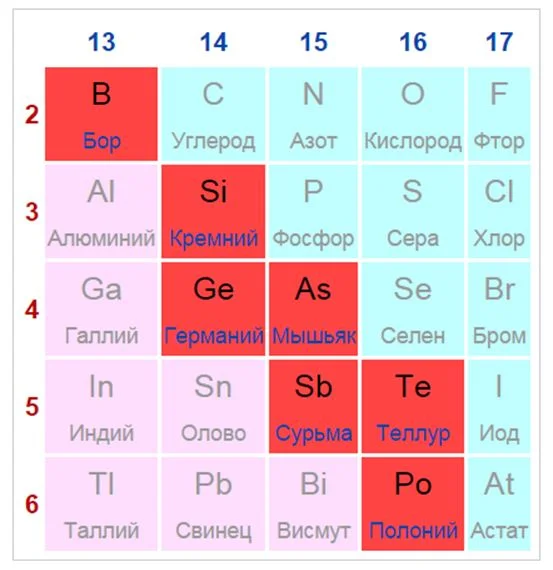
Красные ячейки – полуметаллы
Полуметаллы имеют ковалентную кристаллическую решетку при наличии металлической проводимости (электропроводности). Валентных электронов у них либо недостаточно для образования полноценной ковалентной связи, либо они не удерживаются достаточно прочно из-за больших размеров атома. Поэтому связь в ковалентных кристаллах этих элементов имеет частично металлический характер.
Закономерности в таблице Д.И. Менделеева
Каждый атом состоит из протонов, нейтронов и электронов. Протоны и нейтроны находятся в ядре, который несет положительный заряд. Вокруг ядра движутся отрицательно заряженные электроны. Атомный номер указывает на количество протонов.
Чем больше заряд ядра, тем сильнее к нему притягиваются электроны. Т.о., атому сложнее отдавать электроны. Поэтому в периоде слева направо, с увеличением порядкового номера металлические свойства ослабевают, а неметаллические – усиливаются.
Неметаллы стремятся принять электроны от других атомов. Период в таблице указывает на количество электронных уровней. По мере увеличения числа орбиталей электроны отдаляются от ядра и атому сложнее удерживать электроны на последних уровнях. Т.о., в группе сверху вниз количество орбиталей возрастает, поэтому металлические свойства усиливаются, а неметаллические – уменьшаются.

Характеристика металлов, неметаллов и металлоидов
Периодическая таблица элементов разделена на эти три большие группы элементов в соответствии с их физическими и химическими свойствами и в зависимости от взаимодействия каждого элемента с природой..
Наиболее выдающиеся характеристики каждого из этих элементов описаны ниже:
Характеристики металлов
Наиболее важной характеристикой металлических элементов, без сомнения, является их важная способность проводить тепло и электричество. Наиболее важными электрическими проводниками являются золото, медь и алюминий
С физической точки зрения металлы также обладают способностью отражать свет, поэтому они обычно имеют яркий внешний вид..
Они имеют высокую температуру плавления (выше 600 ° С), поэтому при нормальных условиях окружающей среды они обычно являются твердыми. За исключением ртути, состояние которой при комнатной температуре является жидким.
Кроме того, подавляющее большинство металлов податливы, то есть они способны формировать тонкие листы под действием сил сжатия.
С другой стороны, металлы обычно пластичны. Это означает, что они могут быть отлиты в виде тонких проволок или проволок при растяжении с растягивающими напряжениями.
Характеристики неметаллов
В основном то, что отличает эти элементы от металлов, это неспособность проводить через них тепло и / или электричество..
Кроме того, температуры плавления неметаллов значительно ниже по сравнению с температурой плавления металлов..
Следовательно, неметаллы – это слабые элементы, которые легко ломаются, что означает, что они не являются пластичными или податливыми..
Неметаллы присутствуют в природе в трех состояниях материи. В обычных условиях окружающей среды возможно оценить газы (водород или кислород), жидкости (бром) и твердые вещества (сера или фосфор).
Неметаллы имеют очень разнообразный внешний вид и, как правило, представляют собой элементы низкой плотности с очень низкой яркостью..
Характеристика металлоидов
Эти элементы имеют смешанные свойства металлов и неметаллов. Например, они имеют среднюю тепло- и электропроводность, а также могут быть как яркими, так и непрозрачными..
Как правило, металлоиды являются полупроводниками, то есть повышение температуры также увеличивает их электропроводность.
Благодаря этой последней характеристике они часто используются в области электроники. Примером этого является кремний.
Металлоиды также различаются по плотности, температуре плавления, цвету и форме..
Элементы таблицы Менделеева
Существует также класс «металлоподобных» полупроводников с неопределенным состоянием. Благородные газы, не вступающие в реакции, находятся отдельно.
Часть элементов с номерами больше 100 были обнаружены сравнительно недавно, их принадлежность к какой-либо группе является лишь предположением.
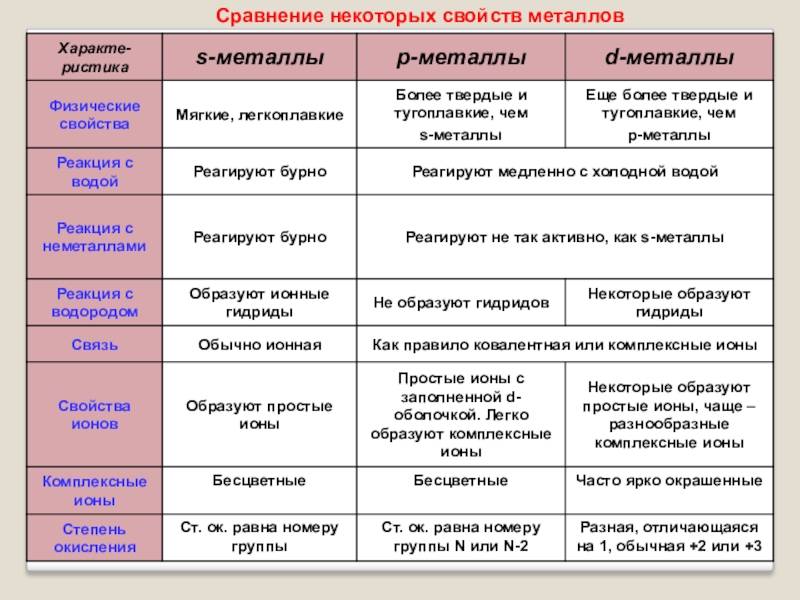
Щелочные и щелочноземельные элементы
Представители групп 1 (IA) и 2 (IIA) таблицы Менделеева — металлы с плохой стабильностью и высокой степенью растворимости.
Щелочные металлы имеют серебристый блеск и легко ломаются и режут. Из всех помещенных на столе металлов они активнее других реагируют с молекулами других веществ, отдавая единственный свободный электрон. При контакте с водой образуются гидроксиды – щелочи:
2Na + 2H2O = 2NaOH + H2
Щелочноземельные металлы более твердые и тугоплавкие, с бледно-серым оттенком.
Большинство из них способны создавать щелочь, но их не так легко отделить от двух незанятых электронов. Они заменяют другие металлы, но бессильны против щелочных металлов и вытесняются ими из молекул.
Галогены и благородные газы
Галогены и благородные газы сгруппированы в группы 17 и 18 периодической таблицы. Галогены — неметаллические элементы, все они имеют семь электронов на внешней оболочке. В благородных газах все электроны находятся на внешней оболочке, поэтому практически не участвуют в образовании соединений. Эти газы называются «благородными», потому что они редко реагируют с другими элементами; то есть относится к членам благородной касты, которые традиционно избегали других людей в обществе.
| Галогены | Благородные газы |
| Фтор F 9 | Гелий он 2 |
| Хлор Cl 17 | Неон Неон 10 |
| Бром Бр 35 | Аргон Ар 18 |
| Йод I 53 | Криптон Кр 36 |
| Астатин в 85 лет | Ксенон Хе 54 |
| — | Радоновый р-н 86 |
Лантаниды (редкоземельные элементы) и актиниды
Лантаниды представляют собой группу элементов, изначально обнаруженных в редких минералах; отсюда и название «редкоземельные элементы». Впоследствии оказалось, что эти элементы не так редки, как считалось сначала, и поэтому редкоземельным элементам было дано название лантаноиды. Лантаниды и актиноиды занимают два блока, которые расположены ниже основной таблицы элементов. Обе группы включают металлы; все лантаноиды (кроме прометия) не радиоактивны; актиниды, с другой стороны, радиоактивны.
| Лантаноиды | Актиниды |
| Лантан Ла 57 | Актиний Ac 89 |
| Церий Се 58 | Торий Th 90 |
| Празеодим Пр 59 | Протактиний Па 91 |
| Неодим Nd 60 | Уран U 92 |
| Прометий Pm 61 | Нептуний Np 93 |
| Самарий См 62 | Плутоний Pu 94 |
| Европий Eu 63 | Америций Ам 95 |
| Гадолиний Бог 64 | Кюриум см 96 |
| Тербий Тб 65 | Берклиум Бк 97 |
| Диспрозий Dy 66 | Калифорния cf 98 |
| Гольмий Хо 67 | Эйнштейний 99 |
| Эрбий Er 68 | Ферми FM 100 |
| Тулий Тм 69 | Менделевий Мд 101 |
| Иттербий Yb 70 | Нобелий № 102 |
Неметаллы
Из всех элементов, отнесенных к неметаллам, водород принадлежит к первой группе таблицы Менделеева, а остальные к группам 13-18. Неметаллы не являются хорошими проводниками тепла и электричества. Обычно они находятся в газообразном (водород или кислород) или твердом (углерод) состоянии при комнатной температуре).
| Нет металлов |
| Водород H1 |
| C6 углерод |
| Азот №7 |
| Кислород О8 |
| Фосфор Р 15 |
| Сера S16 |
| Селен Se 34 |
| Флеровиум Фл 114 |
| Унунсептиус Уус 117 |
Металлоиды
Металлоиды занимают 13-16 группы периодической таблицы. Металлоиды, такие как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных микросхем и печатных плат.
| Металлоиды |
| Бор B5 |
| Кремний Да 14 |
| Германий Ge 32 |
| Мышьяк As 33 |
| Сурьма Sb 51 |
| Теллур Те 52 |
| Полоний Ро 84 |
Переходные металлы
Переходные металлы занимают группы 3-12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (через которые они соединяются с другими элементами) находятся в нескольких электронных оболочках.
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ти 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец марганец 25 |
| Железо Fe 26 |
| Кобальт Co27 |
| Никель Ni 28 |
| Медь Cu29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr40 |
| Ниобий Nb 41 |
| Молибден Мо 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh45 |
| Палладий Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Лютеций Лу 71 |
| Гафний Hf 72 |
| Тантал Та 73 |
| Вольфрам W74 |
| Рений Ре 75 |
| Осмий Ос 76 |
| Иридий Ир 77 |
| Платина, часть 78 |
| Au 79 Золото |
| Меркурий ртутного столба 80 |
| Лоуренсио Lr 103 |
| Резерфордий Rf 104 |
| Дубний Дб 105 |
| Сиборгиум Sg 106 |
| Бори Бх 107 |
| Хассиум Hs 108 |
| Мейтнериум гора 109 |
| Дармштадт Дс 110 |
| Рентген Рг 111 |
| Коперник Cn 112 |
Постпереходные металлы
Они тоже «легкие». Отличаются от переходных аналогов меньшей твердостью и весом. У них разные температуры плавления и кипения. Для соединений электроны отдаются только с внешней оболочки. По степени восстановления они превосходят полуметаллы. Легкий металл выглядит как вещество с матовым покрытием, а не блестящим.
Неметаллы: Разнообразные состояния и свойства
В отличие от металлов, неметаллы включают в себя широкий спектр элементов, которые могут существовать в различных состояниях: твердом, жидком и газообразном. Несмотря на отсутствие типичных металлических свойств, неметаллы обладают собственными уникальными характеристиками.
3.1 Блеск неметаллов
В отличие от металлов, неметаллы не имеют металлического блеска и выглядят тусклыми или матовыми. Это объясняется их атомной структурой, которая не способствует отражению и рассеиванию света так же как металлы.
3.2 Плохие проводники
Неметаллы, как правило, являются плохими проводниками электричества и тепла. В отличие от металлов, их внешние электроны плотно связаны и не могут свободно перемещаться, что препятствует прохождению электрического тока и тепловой энергии. Это свойство делает неметаллы полезными в качестве изоляторов в различных областях применения.
3.3 Хрупкость и неплавкость
Большинство неметаллов хрупкие, то есть они склонны к разрушению или осыпанию при воздействии на них напряжения или давления. Их атомное строение не обеспечивает такой же степени гибкости, как у металлов, что приводит к отсутствию податливости. Однако из этого правила есть исключения, такие как графит и кристаллический йод, которые обладают
Конечно! Прошу прощения за прерванный разговор. Давайте продолжим.
3.3 Хрупкость и неплавкость
Большинство неметаллов хрупкие, то есть они склонны к разрушению или осыпанию при воздействии напряжения или давления. Их атомное строение не обеспечивает такой же степени гибкости, как у металлов, что приводит к отсутствию податливости. Однако из этого правила есть исключения, такие как графит и кристаллический йод, которые обладают слоистой структурой, позволяющей им проявлять некоторую степень пластичности.
3.4 Примеры неметаллов
Неметаллы включают в себя широкий спектр элементов, в том числе углерод, азот, кислород, серу и гелий. Каждый из этих элементов имеет свои свойства и применение. Например, углерод известен своим присутствием в органических соединениях и играет фундаментальную роль в жизни, какой мы ее знаем. Азот является важнейшим компонентом атмосферы Земли, а кислород жизненно необходим для поддержания жизни посредством дыхания.
Распространение металлов и неметаллов в природе
Металлы, такие как железо, медь, алюминий и др., относятся к самым распространенным элементам в земной коре. Они широко распространены и встречаются в различных геологических формациях, таких как рудные жилы, песчаники и плотные горные породы. Некоторые металлы могут находиться в природном состоянии в виде металлических зерен или незначительных примесей в горных породах. Однако большинство металлов находятся в виде минералов, которые требуют дополнительной обработки, чтобы их можно было извлечь.
С другой стороны, неметаллы, такие как кислород, углерод, сера и др., обычно не находятся в природе в виде металлических элементов. Они встречаются в различных формах и соединениях, таких как оксиды, сульфиды и гидраты. Некоторые неметаллы могут быть весьма распространены в природе, например, кислород составляет около 21% атмосферного воздуха, а углерод найден в виде алмазов, графита и органических соединений.
Распространение металлов и неметаллов в природе может варьироваться в зависимости от географического местоположения и геологических условий. Некоторые регионы могут быть богатыми металлическими рудами, такими как золото или серебро, в то время как другие могут быть бедными на них. Аналогично, некоторые регионы могут содержать обильные запасы неметаллических минералов, таких как каменный уголь или сера, в то время как другие регионы могут быть лишены их.
Таким образом, распространение металлов и неметаллов в природе является сложным и многообразным процессом, который обусловлен различными факторами. Изучение и понимание этого процесса позволяет нам лучше понимать и использовать ресурсы природы в наших потребностях и развитии.