Откуда появилась великая таблица Мендлеева?
 Памятники Менделееву существуют во всех странах мира
Памятники Менделееву существуют во всех странах мира
К моменту появления периодической таблицы в 1869 году было открыто 63 химических элемента. Все они представлялись в виде хаотического набора, хотя попытки какого-то упорядочения совершались регулярно.
Первой известной публикацией на этот счет стал «закон триад» (1829 год) Иоганна Дёберейнера, однако он дальше понимания связи атомной массы и химических свойств элементов не продвинулся.
Позднее Александр Эмиль Шанкуртуа создал «Теллуров винт» (1862), разместив элементы на винтовой линии. Ему удалось увидеть частое циклическое повторение химических свойств по вертикали.
Самой правдоподобной стала система Юлиуса Лотара Мейера (1864), который смог составить таблицу, упорядочив элементы по свойствам и весам. Увы, он взял за основу периодичности свойств валентность, что оказалось ошибкой.
 Главный конкурент, который подсказал идею: Лотар Мейер
Главный конкурент, который подсказал идею: Лотар Мейер
Менделеев, по собственным словам, занимался проблемой систематизации химических элементов на протяжении 20 лет (а не спонтанно во время сна, вопреки устоявшемуся мнению), перекладывая карточки с названием и свойствами элементов в поиске нужной комбинации.
И в 1869 ему удалось найти ответ, опубликованный в статье журнала Русского химического общества «Соотношение свойств с атомным весом элементов».
 Периодическая таблица Мейера довольно скудна
Периодическая таблица Мейера довольно скудна
Чуть позже идею подхватил Мейер, опубликовав собственную работу с аналогичным результатом. Знал ли он о достижении Менделеева? Незивестно. К тому же он смог организовать лишь 28 элементов
Однако, из-за него в Европе и США Периодическая таблица Менделеева не имеет в названии имени собственного.
Тем не менее, мировое сообщество ученых трижды выдвигало Менделеева лауреатом Нобелевской премии. Увы, ему не удалось стать членом Российской академии наук, а её члены раз за разом отвергали кандидатуру.
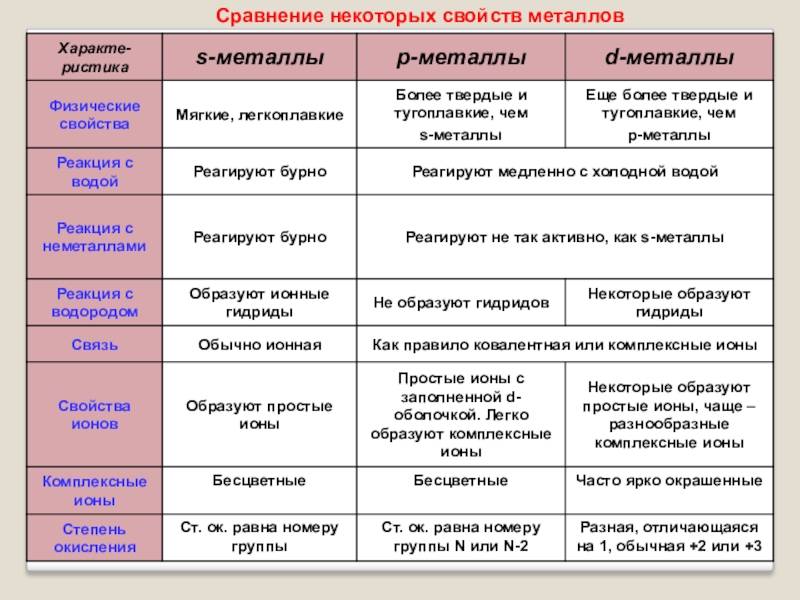
Общие физические свойства
Существуют общие физические свойства металлов. К ним относятся:
- Пластичность.
- Характерный блеск.
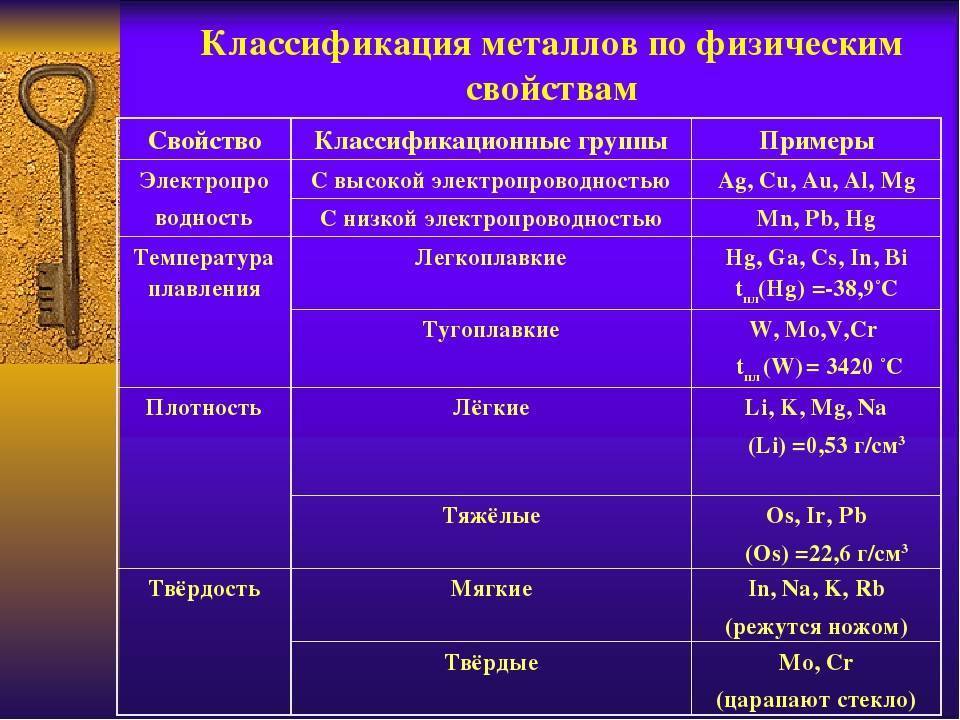
- Электропроводность.
- Высокая теплопроводность.
- Все, кроме ртути, находятся в твердом состоянии.
Следует понимать, что свойства металлов очень различаются относительно их химической или физической сути. Некоторые из них мало похожи на металлы в обыденном понимании этого термина. Например, ртуть занимает особенное положение. Она при обычных условиях находится в жидком состоянии, не имеет кристаллической решетки, наличию которой обязаны своими свойствами другие металлы. Свойства последних в этом случае условны, с ними ртуть роднят в большей степени химические характеристики.
Интересно! Элементы первой группы, щелочные металлы, в чистом виде не встречаются, находясь в составе различных соединений.
Самый мягкий металл, существующий в природе — цезий — относится к этой группе. Он, как и другие щелочные подобные вещества, мало общего имеет с более типичными металлами. Некоторые источники утверждают, что на самом деле, самый мягкий металл калий, что сложно оспорить или подтвердить, поскольку ни тот, ни другой элемент не существует сам по себе — будучи выделенным в результате химической реакци они быстро окисляются или вступают в реакцию.
Вторая группа металлов — щелочноземельные — намного ближе к основным группам. Название «щелочноземельные» происходит из древних времен, когда окислы назывались «землями», поскольку они имеют рыхлую рассыпчатую структуру. Более-менее привычными (в обиходном смысле) свойствами обладают металлы начиная с 3 группы. С увеличением номера группы количество металлов убывает
Дмитрий Менделеев смог создать уникальную таблицу химических элементов, главным достоинством которой была периодичность. Металлы и неметаллы в таблице Менделеева располагаются так, что их свойства изменяются периодическим образом.
Периодическая система была составлена Дмитрием Менделеевым во второй половине 19 века. Открытие не только позволило упростить работу химиков, она смогла объединить в себе как в единой системе все открытые химические вещества, а также предсказать будущие открытия.
Создание данной структурированной системы бесценно для науки и для человечества в целом. Именно это открытие дало толчок развитию всей химии на долгие годы.
В интервью одному журналисту ученый объяснил, что работал над ней 25 лет и то, что она ему снилась – вполне естественно, но это не значит, что во сне пришли все ответы.
Созданная Менделеевым система делится на две части:
- периоды – столбики по горизонтали в одну или две строки (ряды);
- группы – вертикальные строчки, в один ряд.
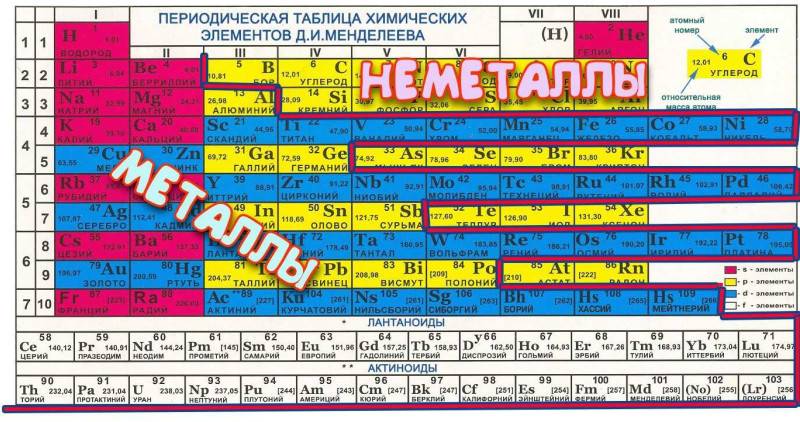
Всего в системе 7 периодов, каждый следующий элемент отличен от предыдущего большим количеством электронов в ядре, т.е. заряд ядра каждого правого показателя больше левого на единицу. Каждый период начинается с металла, а заканчивается инертным газом – именно это и есть периодичность таблицы, ведь свойства соединений меняются внутри одного периода и повторяются в следующем
. При этом, следует помнить, что 1-3 периоды неполные или малые, в них всего 2, 8 и 8 представителей. В полном периоде (т.е. оставшихся четырех) по 18 химических представителей.
 В группе располагаются химические соединения с одинаковой высшей , т.е. у них одинаковое электронное строение. Всего в системе представлено 18 групп (полная версия), каждая из которых начинается щелочью и заканчивается инертным газом. Все, представленные в системе субстанции, можно разделить на две основные группы – металл или неметалл.
В группе располагаются химические соединения с одинаковой высшей , т.е. у них одинаковое электронное строение. Всего в системе представлено 18 групп (полная версия), каждая из которых начинается щелочью и заканчивается инертным газом. Все, представленные в системе субстанции, можно разделить на две основные группы – металл или неметалл.
Для облегчения поиска группы имеют свое название, а металлические свойства субстанций усиливаются с каждой нижней строчкой, т.е. чем ниже соединение, тем больше у него будет атомных орбит и тем слабее электронные связи. Также меняется и кристаллическая решетка – она становится ярко выраженной у элементов с большим количеством атомных орбит.
В химии используют три вида таблиц:
- Короткая – актиноиды и лантаноиды вынесены за границы основного поля, а 4 и все последующие периоды занимают по 2 строчки.
- Длинная – в ней актиноиды и лантаноиды вынесены за границу основного поля.
- Сверхдлинная – каждый период занимает ровно 1 строку.
Главной считается та таблица Менделеева, которая была принята и подтверждена официально, но для удобства чаще используют короткую версию. Металлы и неметаллы в таблице Менделеева располагаются согласно строгим правилам, которые облегчают работу с ней.
Общая характеристика металлов
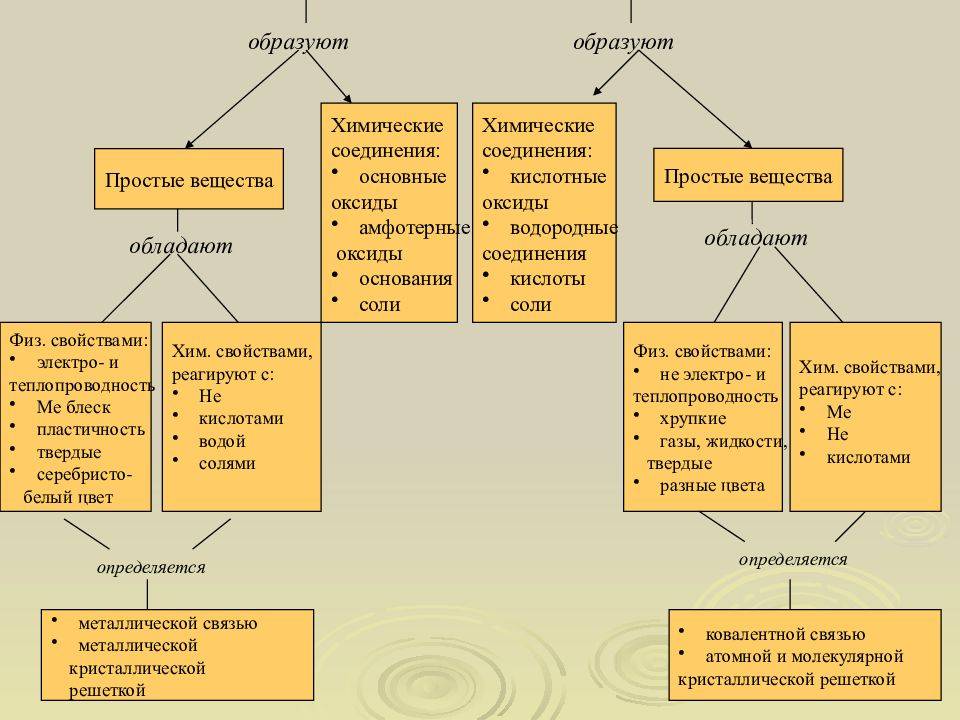
Все химические элементы делятся на металлы и неметаллы. В основе такого деления лежит различие в строении атомов элементов.
Неметаллы в таблице Периодической системы Менделеева занимают правый верхний угол (желтые ячейки на рисунке внизу):
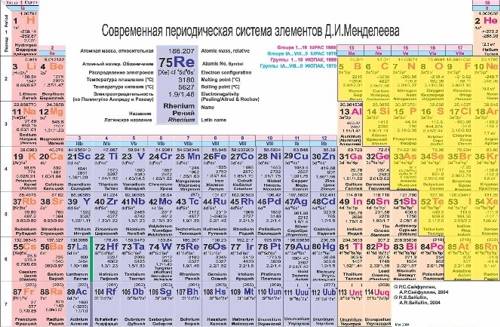
Все остальные, не желтые ячейки плюс водород и гелий – занимают металлы. Таким образом, неметаллы и металлы в Периодической таблице разделены условной диагональю бор-астат.
Химические элементы, расположенные в непосредственной близости от этой диагонали (алюминий, титан, галлий, германий, сурьма, теллур, астат), имеют двойственные свойства, реагируя в некоторых случаях, как металлы, а в других – как неметаллы.
Закономерности расположения элементов в периодах (слева-направо):
- Радиус атома – уменьшается;
- Заряд ядра – увеличивается;
- Электроотрицательность – увеличивается;
- Кол-во электронов на внешнем слое – увеличивается;
- Прочность связи внешних электронов с ядром атома – увеличивается;
- Способность отдавать электроны – уменьшается.
Исходя из вышеуказанных закономерностей, нетрудно догадаться, что металлы находятся в начале каждого периода (слева), а неметаллы – в конце (справа).
Атомы металлов:
- как правило, на внешнем электронном слое имеют 1-3 электрона (4 электрона у Ge, Sn, Pb; 5 – у Sb, Bi; 6 – у Po);
- имеют больший размер атома и меньший заряд его ядра, по сравнению с неметаллами своего периода;
- имеют высокопрочную связь внешних электронов с ядром атома;
- легко расстаются с валентными электронами, превращаясь в катионы.
При н.у. все металлы (за исключением ртути) являются твердыми веществами, обладающими прочной кристаллической решеткой, образованной за счет металлических связей. Между узлами кристаллической решетки находятся свободные электроны, которые могут переносить теплоту и проводить электрический ток. Поэтому, в отличие от неметаллов, металлы хорошо проводят тепло и обладают высокой электропроводностью.
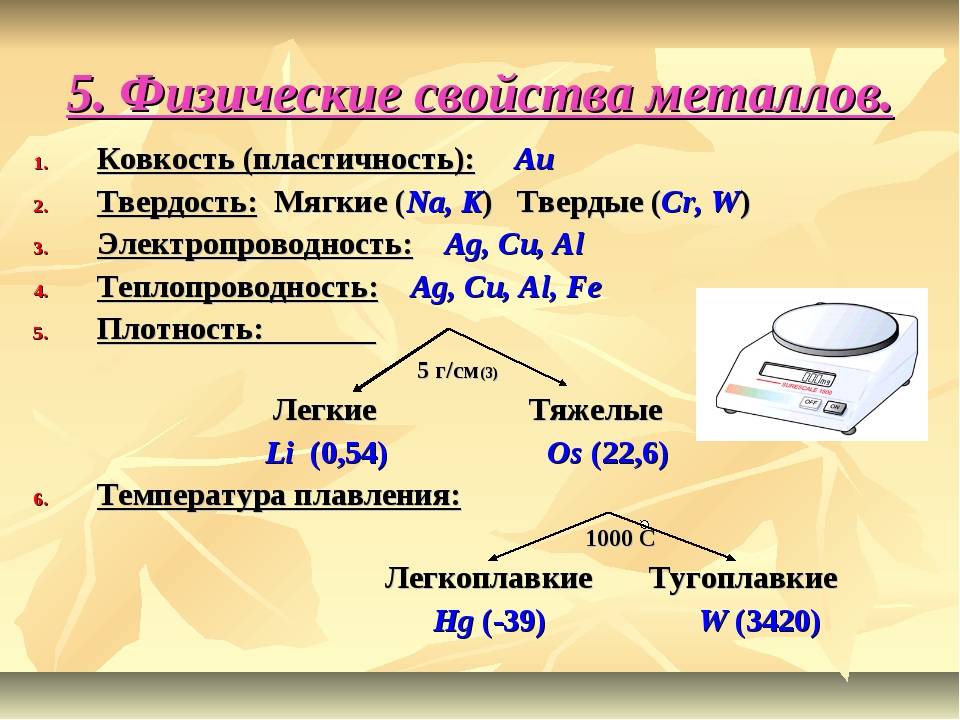
Физические свойства металлов:
- твердые вещества (кроме ртути);
- обладают характерным металлическим блеском;
- обладают высокой электро- и теплопроводностью;
- обладают высокими механическими качествами: упругостью, пластичностью, прочностью.
Самыми мягкими металлами являются калий и натрий (их можно резать ножом), самый твердый металл – хром (царапает стекло).
Самый легкоплавкий металл ртуть (-38,9°C), самый тугоплавкий – вольфрам (3380°C).
Самая низкая плотность у лития (0,59 г/см3), самая высокая – у осмия (22,48 г/см3).
Еще одной характерной особенностью металлов является их способность намагничиваться:
- ферромагнетики обладают высокой способностью намагничиваться даже под действием незначительного магнитного поля (железо, никель);
- парамагнетики проявляются слабую способность к намагничиванию (алюминий, хром);
- диамагнетики не намагничиваются (олово, медь).
Плотность и масса
В общем случае, неметаллы имеют намного меньшую плотность по сравнению с металлами. Это связано с их атомной структурой и особыми свойствами атомов, из которых они состоят.
Например, углерод — неметалл, который обычно находится в твердом состоянии в виде алмаза или графита. Плотность алмаза составляет около 3,5 г/см³, а графита — около 2,2 г/см³. На другом конце спектра, у металлов, таких как железо или алюминий, плотность составляет 7,87 г/см³ и 2,7 г/см³ соответственно.
Масса — это физическая величина, которая характеризует количество вещества. Неметаллы обычно имеют меньшую массу по сравнению с металлами. Это связано с тем, что неметаллы образуют более легкие атомы и молекулы, которые имеют меньшую среднюю атомную массу.
Например, масса углерода составляет около 12 атомных единиц, тогда как масса железа составляет около 56 атомных единиц.
Таким образом, различие в плотности и массе между неметаллами и металлами определяется их структурой и свойствами атомов, из которых они состоят
Эти различия имеют важное значение для многих аспектов нашей жизни, таких как использование материалов и разработка новых технологий
Физические свойства металлов
Металлы обладают рядом особенных физических свойств, которые делают их уникальными и полезными в различных областях. Вот некоторые из них:
- Проводимость электричества и тепла: Металлы обладают высокой электрической и тепловой проводимостью. Это позволяет им быть хорошими материалами для проводов, электрических контактов и теплообменных элементов.
- Металлический блеск: Многие металлы имеют характерный блеск, который делает их привлекательными с эстетической точки зрения. Это связано с их способностью отражать свет.
- Пластичность и формоваемость: Металлы могут быть легко деформированы путем нанесения давления. Это позволяет создавать различные формы и конструкции из металла.
- Прочность и твердость: Металлы обычно обладают высокой прочностью и твердостью, что делает их подходящими для использования в различных конструкциях и механизмах.
- Плавление и кипение: Многие металлы имеют высокую температуру плавления и кипения, что значительно выше, чем у неметаллов. Это позволяет использовать их в различных процессах нагрева и плавления.
- Магнитные свойства: Некоторые металлы обладают магнитными свойствами и могут притягиваться к магниту.
Все эти физические свойства делают металлы важными и необходимыми материалами в нашей повседневной жизни и промышленности.
Проводимость электричества и тепла
Физические свойства неметаллов отличаются от физических свойств металлов во многих аспектах, включая проводимость электричества и тепла.
Металлы, такие как железо, медь и алюминий, обладают хорошей электропроводностью. Это означает, что они легко передают электрический заряд по своей структуре. Из-за наличия свободных электронов, металлическая структура позволяет электричеству свободно перемещаться через материал.
Неметаллы, например сера, фосфор и кремний, обычно не обладают хорошей проводимостью электричества. Это связано с их атомной структурой, которая не обеспечивает наличие свободных электронов. В неметаллических материалах электрический заряд передается путем передвижения ионов или других частиц с электрическим зарядом.
В отличие от металлов, которые хорошо проводят тепло, неметаллы обычно являются плохими проводниками тепла. Это связано с их структурой, которая не обеспечивает свободное движение тепловой энергии. Вместо этого, тепло передается в неметаллических материалах путем молекулярных колебаний и столкновений.
Однако есть исключения, например графит, который является формой углерода и обладает хорошей проводимостью как электричества, так и тепла. Это связано с его специфической структурой, где атомы углерода образуют слоистую решетку, в которой электроны могут свободно перемещаться.
В итоге, проводимость электричества и тепла являются важными физическими свойствами, которые отличают металлы от неметаллов. Понимание этих различий имеет широкое применение в различных областях науки и технологии.
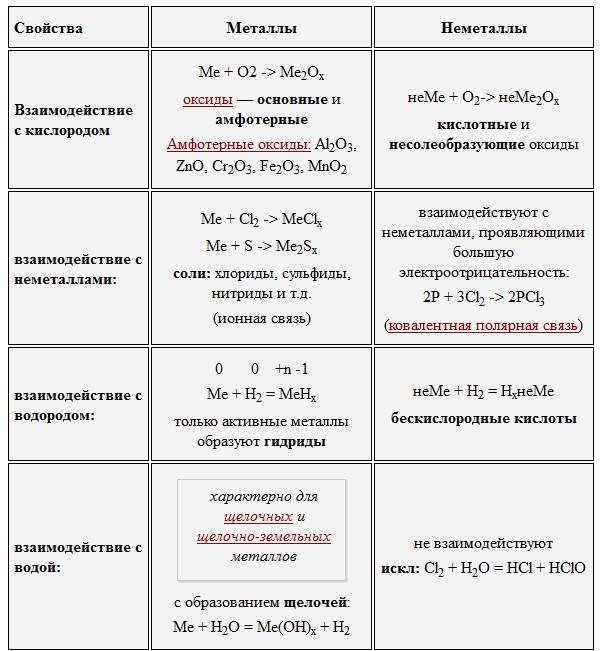
Химические свойства металлов
Металлы легко отдают электроны, т. е. являются восстановителями. Поэтому они легко реагируют с окислителями.
Вопросы
- Какие атомы являются окислителями?
- Как называются простые вещества, состоящие из атомов, которые способны принимать электроны?
Таким образом, металлы реагируют с неметаллами. В таких реакциях неметаллы, принимая электроны, приобретают обычно НИЗШУЮ степень окисления.
Рассмотрим пример. Пусть алюминий реагирует с серой:
Вопрос. Какой из этих химических элементов способен только отдавать электроны? Сколько электронов?
Алюминий — металл, имеющий на внешнем уровне 3 электрона (III группа!), поэтому он отдаёт 3 электрона:
Поскольку атом алюминия отдает электроны, атом серы принимает их.
Вопрос. Сколько электронов может принять атом серы до завершения внешнего уровня? Почему?
У атома серы на внешнем уровне 6 электронов (VI группа!), следовательно, этот атом принимает 2 электрона:
Таким образом, полученное соединение имеет состав:
В результате получаем уравнение реакции:
Задание 8.5. Составьте, рассуждая аналогично, уравнения реакций:
- кальций + хлор (Cl2);
- магний + азот (N2).
Составляя уравнения реакций, помните, что атом металла отдаёт все внешние электроны, а атом неметалла принимает столько электронов, сколько их не хватает до восьми.
Названия полученных в таких реакциях соединений всегда содержат суффикс ИД:
Корень слова в названии происходит от латинского названия неметалла (см. урок 2.4).
Металлы реагируют с растворами кислот (см. урок 2.2). При составлении уравнений подобных реакций и при определении возможности такой реакции следует пользоваться рядом напряжений (рядом активности) металлов:
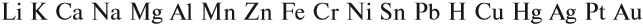
Металлы, стоящие в этом ряду до водорода, способны вытеснять водород из растворов кислот:
Задание 8.6. Составьте уравнения возможных реакций:
- магний + серная кислота;
- никель + соляная кислота;
- ртуть + соляная кислота.
Все эти металлы в полученных соединениях двухвалентны.
Реакция металла с кислотой возможна, если в результате её получается растворимая соль. Например, магний практически не реагирует с фосфорной кислотой, поскольку его поверхность быстро покрывается слоем нерастворимого фосфата:
Металлы, стоящие после водорода, могут реагировать с некоторыми кислотами, но водород в этих реакциях не выделяется:
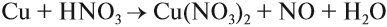
Задание 8.7. Какой из металлов — Ва, Mg, Fе, Рb, Сu — может реагировать с раствором серной кислоты? Почему? Составьте уравнения возможных реакций.
Металлы реагируют с водой, если они активнее железа (железо также может реагировать с водой). При этом очень активные металлы (Li – Al) реагируют с водой при нормальных условиях или при небольшом нагревании по схеме:
где х — валентность металла.
Задание 8.8. Составьте уравнения реакций по этой схеме для К, Nа, Са. Какие ещё металлы могут реагировать с водой подобным образом?
Возникает вопрос: почему алюминий практически не реагирует с водой? Действительно, мы кипятим воду в алюминиевой посуде, — и… ничего! Дело, в том, что поверхность алюминия защищена оксидной пленкой (условно — Al2O3). Если её разрушить, то начнётся реакция алюминия с водой, причём довольно активная. Полезно знать, что эту плёнку разрушают ионы хлора Cl–. А поскольку ионы алюминия небезопасны для здоровья, следует выполнять правило: в алюминиевой посуде нельзя хранить сильно солёные продукты!
Вопрос. Можно ли хранить в алюминиевой посуде кислые щи, компот?
Менее активные металлы, которые стоят в ряду напряжений после алюминия, реагируют с водой в сильно измельчённом состоянии и при сильном нагревании (выше 100 °C) по схеме:
Металлы, менее активные, чем железо, с водой не реагируют!
Металлы реагируют с растворами солей. При этом более активные металлы вытесняют менее активный металл из раствора его соли:

Задание 8.9. Какие из следующих реакций возможны и почему:
- серебро + нитрат меди II;
- никель + нитрат свинца II;
- медь + нитрат ртути II;
- цинк + нитрат никеля II.
Составьте уравнения возможных реакций. Для невозможных поясните, почему они невозможны.
Следует отметить (!), что очень активные металлы, которые при нормальных условиях реагируют с водой, не вытесняют другие металлы из растворов их солей, поскольку они реагируют с водой, а не с солью:
А затем полученная щёлочь реагирует с солью:
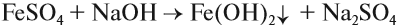
Поэтому реакция между сульфатом железа и натрием НЕ сопровождается вытеснением менее активного металла:
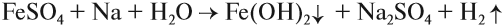
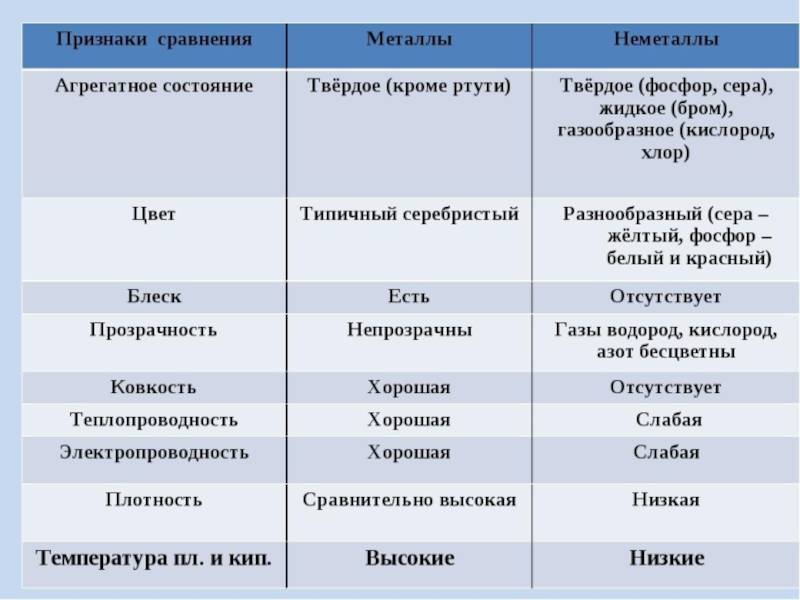
Физические свойства неметаллов
Неметаллы обладают рядом характеристик, которые отличают их от металлов:
- Отсутствие блеска: В отличие от металлов, неметаллы не обладают блестящей поверхностью.
- Тепло- и электропроводность: Неметаллы плохо проводят тепло и электричество. Это связано с их особенностями строения атомов и молекул.
- Избирательная прозрачность: Некоторые неметаллы, такие как сера или фосфор, могут быть прозрачными только в определенных формах, например, в виде аморфных или однородных кристаллов.
- Хрупкость: Неметаллы обычно являются хрупкими и легко разрушаются при повреждении. Зато металлы обычно обладают деформационной способностью.
- Низкая плотность: Неметаллы имеют меньшую плотность по сравнению с металлами. Это делает их легче и более подвижными.
- Низкая температура плавления: Большинство неметаллов обладает низкой температурой плавления по сравнению с металлами, что делает их менее жароустойчивыми.
Эти физические свойства неметаллов определяют многие их химические и технические характеристики, а также их применение в различных отраслях промышленности.
Проводимость электричества и тепла
Неметаллы, в отличие от металлов, имеют низкую проводимость электричества и тепла. Они являются плохими проводниками и сопротивляются протеканию электрического тока. Более того, некоторые неметаллы могут быть диэлектриками, то есть иметь очень низкую электрическую проводимость.
Это различие в проводимости электричества и тепла обусловлено особенностями строения молекул и атомов неметаллов. В металлах электроны свободно движутся по всей структуре, что обеспечивает их высокую проводимость. В неметаллах электроны сильно связаны с атомами и не могут свободно двигаться.
Проводимость тепла также связана с проводимостью электричества, поскольку тепло является формой энергии и может передаваться через движение электронов. Поэтому ненметаллы, не обладая высокой проводимостью электричества, также обладают низкой теплопроводностью.
Из-за низкой электрической и тепловой проводимости неметаллы широко применяются в изоляционных материалах и термических защитных покрытиях, таких как пенопласт, стекловолокно и керамические материалы.
Твердость и пластичность
Твердость — это способность материала сопротивляться деформации под действием внешних усилий. Металлы обычно обладают высокой твердостью, что позволяет им сохранять свою форму и структуру при механическом воздействии. Например, сталь имеет высокую твердость и может быть использована для создания прочных и прочностных конструкций.
В отличие от металлов, неметаллы обычно обладают низкой твердостью. Они могут быть хрупкими и легко разрушаться под воздействием механических сил. Например, стекло — это неметаллический материал с низкой твердостью, который может легко разбиться при ударе.
Пластичность — это способность материала изменять свою форму без разрушения под действием механических сил. Металлы характеризуются высокой пластичностью, что позволяет им быть формованными и обрабатываемыми. Например, алюминий — это металл с высокой пластичностью, который легко поддается прокатке и литью.
Неметаллы, напротив, обычно обладают низкой пластичностью. Они трудно поддаются формовке и обработке, так как могут быть хрупкими и легко разрушаться. Например, керамика — это неметаллический материал с низкой пластичностью, который сложно обрабатывать и формировать.
| Свойство | Металлы | Неметаллы |
|---|---|---|
| Твердость | Высокая | Низкая |
| Пластичность | Высокая | Низкая |
Плотность и легкость
Наиболее известные примеры таких легких неметаллов включают в себя карбон, кислород, азот и водород. Карбон представлен такими формами, как графит и алмаз, и используется в различных областях человеческой деятельности, от производства карандашей до изготовления алмазных украшений. Кислород и азот являются важными газами, составляющими атмосферу Земли, и необходимы для поддержания жизни. Водород, в свою очередь, является самым легким элементом в периодической таблице и часто используется в процессах химической синтеза.
Кроме того, неметаллы обычно обладают более низкой плотностью, что делает их легкими и удобными для использования в различных областях, например, в строительстве, электронике и авиационной промышленности. Некоторые классы неметаллов, такие как полимеры, обладают особенно низкой плотностью, что делает их идеальными для создания легких, но прочных материалов.
Таким образом, плотность и легкость являются важными физическими свойствами неметаллов, которые отличают их от металлов и обуславливают их широкое применение в различных отраслях промышленности и науки.
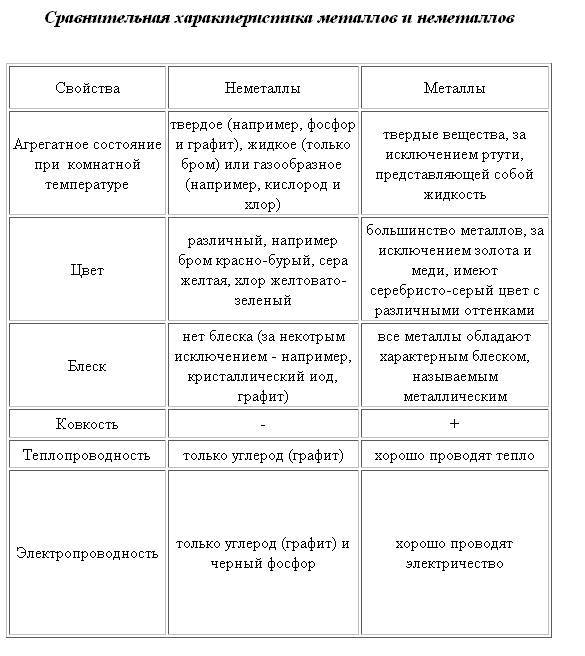
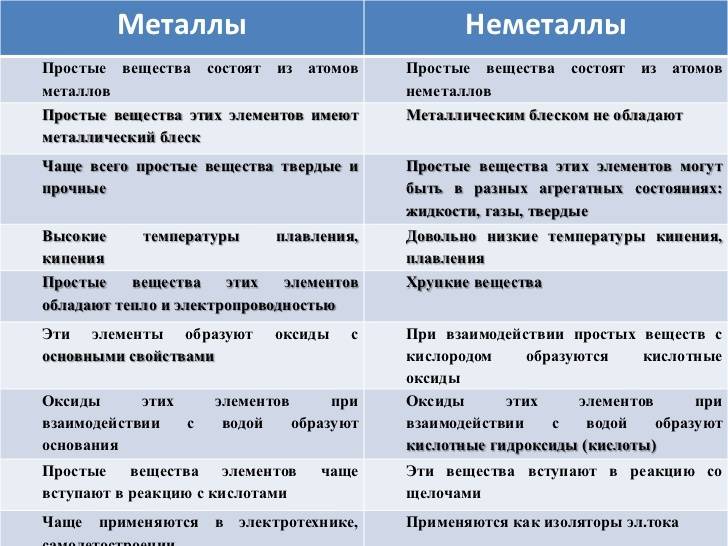
Основные различия между металлами и неметаллами
Разница между металлами и неметаллами может быть четко обозначена в следующих условиях:
- Твердые, блестящие, непрозрачные и плотные природные элементы – это металлы. Химические вещества, которые являются мягкими, не блестящими, прозрачными и ломкими, являются неметаллами.
- Металлы являются электроположительными по своей природе, поскольку они легко теряют электроны, поэтому они являются восстановителями. Напротив, неметаллы являются электроотрицательными, потому что они получают электроны и, следовательно, они являются окислителями.
- Металлы имеют кристаллическую структуру, тогда как неметаллы обладают аморфной структурой.
- При комнатной температуре металлы обычно являются твердыми, за исключением ртути и галлия, которые находятся в жидком состоянии. И наоборот, неметаллы могут быть найдены в твердой или газообразной форме, за исключением брома, который является единственным неметаллом, который присутствует в жидкой форме.
- Плотность – это отношение массы к объему; металлы имеют более высокую плотность по сравнению с неметаллами.
- Металлы выглядят гладкими и блестящими, в то время как неметаллы обычно выглядят тусклыми.
- Когда речь идет о твердости, металлы, как правило, являются твердым веществом, но оно варьируется от вещества к веществу. В отличие от неметаллов это мягкое вещество, кроме алмаза, который является самым твердым веществом на земле.
- Ковкость – это характеристика металлов, которые при ударе молотком превращаются в тонкий лист. В отличие от этого неметаллы являются хрупкими, так как при ударе молотком неметаллы разбиваются на куски.
- Пластичность является свойством металлов, которые должны быть втянуты в проволоку, но неметаллы не обладают таким свойством.
- Сонорная – это особенность металлов, дающая глубокий или звонкий звук. Тем не менее, неметаллы не звучат.
- Металлы поддерживают теплопроводность и электричество. И наоборот, неметаллы являются изоляторами, и поэтому они не поддерживают теплопроводность и электричество.
- Металлы имеют очень высокую температуру плавления и кипения. Напротив, неметаллы варят и расплавляют при относительно низкой температуре.
- Во внешней оболочке металлы состоят из 1-3 электронов, а неметаллы состоят из 4-8 электронов.
- Металлы реагируют с кислородом с образованием оксидов металлов, которые являются основными по своей природе, поэтому они имеют электровалентные или ионные связи. С другой стороны, когда неметаллы реагируют с кислородом с образованием неметаллических оксидов кислотной природы, и, таким образом, они имеют ковалентные связи.
- Металлы реагируют с разбавленной кислотой с образованием соли и газообразного водорода. В противоположность этому неметаллы обычно не реагируют с разбавленной кислотой.
Заключение
Все объекты вокруг нас состоят из металлов или неметаллов. Элементы, которые обладают свойствами как металлов, так и неметаллов, называются металлоидами. Включает бор, кремний, германий, мышьяк и др.