Физические свойства
- Йод – это твердое вещество, которое при комнатной температуре образует темно-фиолетовые кристаллы или голубые блестящие пластинки.
- Бром – это также твердое вещество, однако его структура представляет собой черный или красно-коричневый кристаллический порошок.
- Йод практически нерастворим в воде, но хорошо растворяется в органических растворителях, таких как этанол, эфир и хлороформ.
- Бром, в отличие от йода, довольно легко растворяется в воде, образуя оранжево-красное растворение.
- Температура плавления йода составляет около 114 градусов Цельсия, а для брома – около -7 градусов Цельсия.
- Оба элемента обладают характерным запахом. Йод имеет острый, раздражающий запах, в то время как бром имеет насыщенный слегка сладкий запах.
- Бром является токсичным веществом, в то время как йод является необходимым микроэлементом для организма человека и животных.
Температурные условия существования
Йод имеет более высокую температуру плавления по сравнению с бромом. Точка плавления йода составляет около 113 градусов Цельсия, в то время как бром плавится уже при температуре около -7 градусов Цельсия.
Это означает, что при комнатной температуре и ниже йод находится в твердом состоянии, в виде кристаллов или порошка, в то время как бром находится в жидком состоянии.
Поэтому йод является хорошо известным веществом, используемым в медицине и хозяйственных целях, таких как обработка ран и противодействие инфекционным заболеваниям, а бром находит применение в промышленности, например, в процессах производства пластмасс и фотопленок.
Отличия в температурных условиях существования йода и брома являются одной из основных причин, по которым эти два элемента имеют различные применения и свойства.
Состояния при комнатной температуре
Йод при комнатной температуре является твердым веществом, обладающим характерным фиолетово-черным цветом. Он имеет кристаллическую структуру и образует многочисленные микроскопические пластинки. Йод очень низко летучий, что означает, что он практически не испаряется в газообразное состояние при комнатной температуре. Поэтому йод часто используется в медицинских и лабораторных целях, а также в производстве и косметике.
Бром при комнатной температуре является красно-бурой жидкостью с характерным запахом. Он обладает низким уровнем летучести по сравнению с многими другими летучими жидкостями. Благодаря этому, бром используется в различных областях, включая производство осветительных приборов и противопожарных систем.
Таким образом, йод и бром имеют разные агрегатные состояния при комнатной температуре: йод является твердым веществом, а бром — жидкостью.
| Элемент | Состояние | Цвет |
|---|---|---|
| Йод | Твердое | Фиолетово-черный |
| Бром | Жидкое | Красно-бурый |
Химические свойства
В свободном виде существует в виде двухатомных молекул Br2. Заметная диссоциация молекул на атомы наблюдается при температуре 800 °C и быстро возрастает при дальнейшем росте температуры. Диаметр молекулы Br2 равен 0,323 нм, межъядерное расстояние в этой молекуле — 0,228 нм.
Бром немного, но лучше других галогенов растворим в воде (3,58 г на 100 г воды при 20 °C), раствор называют бромной водой. В бромной воде протекает реакция с образованием бромоводородной и неустойчивой бромноватистой кислот:
- Br2 + H2O ⟶ HBr + HBrO
С большинством органических растворителей бром смешивается во всех отношениях, при этом часто происходит бромирование молекул органических растворителей.
По химической активности бром занимает промежуточное положение между хлором и йодом. При реакции брома с растворами йодидов выделяется свободный йод:
- Br2 + 2KI ⟶ I2↓ + 2KBr
Напротив, при действии хлора на бромиды, находящиеся в водных растворах, выделяется свободный бром:
- Cl2 + 2KBr ⟶ Br2 + 2KCl
При реакции брома с серой образуется S2Br2, при реакции брома с фосфором — PBr3 и PBr5. Бром реагирует также с неметаллами селеном и теллуром.
Реакция брома с водородом протекает при нагревании и приводит к образованию бромоводорода HBr. Раствор HBr в воде — это бромоводородная кислота, по силе близкая к соляной кислоте HCl. Соли бромоводородной кислоты — бромиды (NaBr, MgBr2, AlBr3 и др.). Качественная реакция на присутствие бромид-ионов в растворе — образование с ионами Ag+ светло-желтого осадка бромида серебра AgBr, практически нерастворимого в воде.
С кислородом и азотом бром непосредственно не реагирует. Бром образует большое число различных соединений с остальными галогенами. Например, со фтором бром образует неустойчивые BrF3 и BrF5, с йодом — IBr. При взаимодействии со многими металлами бром образует бромиды, например, AlBr3, CuBr2, MgBr2 и др. Устойчивы к действию брома тантал и платина, в меньшей степени — серебро, титан и свинец.
Жидкий бром легко взаимодействует с золотом, образуя трибромид золота AuBr3:
- 2Au + 3Br2 ⟶ 2AuBr3
Бром — сильный окислитель, он окисляет сульфит-ион до сульфата, нитрит-ион — до нитрата и т. д.
При взаимодействии с органическими соединениями, содержащими двойную связь, бром присоединяется, давая соответствующие дибромпроизводные:
- C2H4 + Br2 ⟶ C2H4Br2
Присоединяется бром и к органическим молекулам, в составе которых есть тройная связь. Обесцвечивание бромной воды при пропускании через неё газа или добавлении к ней жидкости свидетельствует о том, что в газе или в жидкости присутствует непредельное соединение.
При нагревании в присутствии катализатора бром реагирует с бензолом с образованием бромбензола C6H5Br (реакция замещения).
При взаимодействии брома с растворами щелочей и с растворами карбонатов натрия или калия образуются соответствующие бромиды и броматы, например:
- 3Br2 + 3Na2CO3 ⟶ 5NaBr + NaBrO3 + 3CO2
Реагирует с родановодородом:
- HSCN + Br2 ⟶ BrCN + HBr + S↓
Бромсодержащие кислоты
Помимо бескислородной бромоводородной кислоты HBr, бром образует ряд кислородных кислот: бромную HBrO4, бромноватую HBrO3, бромистую HBrO2, бромноватистую HBrO.
Галогены тест
Задания ОГЭ по химии, связанные с темой «галогены».
Задание 1
- KOH + Cl2 →
- Fe + Cl2 →
- H2S + Cl2 →
- → FeCl2
- → FeCl3
- → KClO + KCl + H2O
- → KClO3 + HClO
- → HCl + S
Ответ:
| А | Б | В |
|---|---|---|
Ответить
Задание 2
Пример задания из КИМ ЕГЭ:
- Ca(OH) 2 + Cl2 →
- HBr + Cl2 →
- H2O + Cl2 →
- → CaCl2 + Ca(ClO3)2 + H2O
- → HCl + HClO3
- → Ca(ClO)2 + H2O
- →HClO + H2
- →HCl + Br2
Ответ:
| А | Б | В |
|---|---|---|
Ответить
Задание 3
- I2 + Ba(OH) 2→
- I2 + Ba→
- I2 + H2O→
- → BaI2
- → HIO3
- → HIO + HI
- → Ba(IO)2 + BaI2 + H2O
- → Ba(IO3)2
Ответ:
| А | Б | В |
|---|---|---|
Ответить
Задание 4
Попробуйте решить задание ЕГЭ:
- I2
- CaCl2
- HBr
- S, NaOH
- NaF, CuO
- H2O, HCl
- P, HNO3
- AgNO3, Na3PO4
Ответ:
| А | Б | В |
|---|---|---|
Ответить
Задание 5
- NaI
- HF
- Br2
- Fe, H2
- Br2, Pb(NO3)2
- AgCl, Na
- Cu, NaCl
- CaCl2, NaOH
Ответ:
| А | Б | В |
|---|---|---|
Ответить
Задание 6
- Br2O3
- BaBr2
- HI
- H2O, KOH
- SO3, NH4Cl
- Cl2, Na2SO4
- Al(NO3)3, NaF
- AgNO3, Na2CO3
Ответ:
| А | Б | В |
|---|---|---|
Ответить
Задание 7
Дана схема превращений:
HCl → FeCl2 → X → Fe(OH)3
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращенное ионное уравнение реакции.
Задание 8
Дана схема превращений:
H2S → HI → NaI → NaNO3
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращенное ионное уравнение реакции.
Задание 9
Дана схема превращений:
Fe → FeCl3 → X → FeBr3
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращенное ионное уравнение реакции.
Задание 10
Дана схема превращений:
CuI2 → CuBr2 → X → PbBr2
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращенное ионное уравнение реакции.
Реакция с водородом
Йод и бром представляют собой галогены, которые способны проявлять сходные реакции с водородом. Однако, различия между ними можно рассмотреть на молекулярном уровне.
Иод имеет более высокую энергию связи между атомами, поэтому его реакция с водородом более медленная и требует повышенной температуры и присутствия катализатора. Реакцию можно представить следующим образом:
2I2 + H2 → 2HI
Йод вступает в реакцию с молекулой водорода, образуя два молекулы йодистого водорода.
Бром, в свою очередь, более активный элемент, и его реакция с водородом происходит при комнатной температуре и без катализатора. Реакция выглядит следующим образом:
Br2 + H2 → 2HBr
Молекула брома вступает в реакцию с молекулой водорода, образуя две молекулы бромистого водорода.
Таким образом, различие между йодом и бромом при их реакции с водородом заключается в условиях проведения реакции и скоростях их протекания.
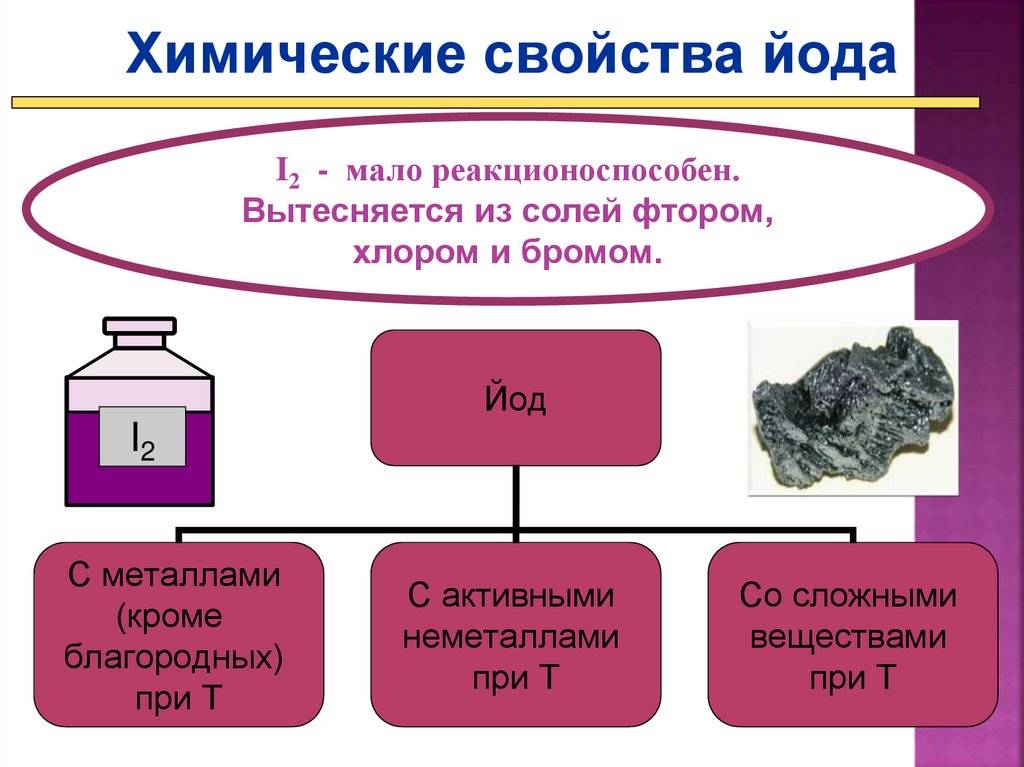
Образование соединений
Йод образует соединения с другими элементами путем подобных реакций, как окисление и замещение. Однако, йод более реакционноспособен, чем бром. Йод просто соединяется с большим количеством элементов, включая металлы и неметаллы.
Бром, в отличие от йода, менее реакционноспособен и образует соединения с ограниченным количеством элементов. Основные способы образования соединений с бромом — это реакции замещения и реакции аддиции.
Соединения йода и брома имеют свои уникальные свойства и применения. Йод используется в медицине (например, в йодированной соли) и в химической промышленности. Бром, с другой стороны, применяется в процессах полимеризации и становится важным компонентом некоторых замедлителей горения.
Взаимодействие иода с металлами
Иод, являясь характерным неметаллом, обладает низкой реакционной активностью по сравнению с другими халькогенами. Его взаимодействие с металлами наиболее характерно для щелочных металлов, таких как натрий и калий. При этом иод образует иодиды металлов, которые обладают хорошей растворимостью в воде и придают растворам ярко-желтый цвет.
Взаимодействие иода с щелочными металлами протекает по следующей реакционной схеме:
Металл + иод → иодид металла
Примером такой реакции может служить взаимодействие иода с натрием:
2Na + I2 → 2NaI
Иодид натрия полученный в результате данной реакции является белым кристаллическим веществом с хорошей растворимостью в воде.
Однако, с другими металлами, такими как алюминий, железо или медь, иод взаимодействует не так интенсивно. При этом образуются соответствующие иодиды металлов, которые обладают низкой растворимостью в воде.
Таким образом, взаимодействие иода с металлами зависит от их характеристик и ведет к образованию соответствующих иодидов металлов, которые отличаются своими физическими и химическими свойствами.
Йод
Йод в кристаллах
Йод (I2) (tпл=114 °С, tкип=185 °С) хорошо знаком каждому с детства: 5-процентный водно-спиртовой раствор йода используют для дезинфекции ран и порезов. Если вылить раствор йода в фарфоровую чашечку и оставить на несколько часов, то спирт испарится и выделится кристаллический йод в виде серых кристаллов с металлическим блеском, хорошо растворимых в органических растворителях. При небольшом нагревании кристаллический йод возгоняется, образуя пары фиолетового цвета.
Как и хлор, фтор, бром, йод – тоже принадлежит к семейству галогенов. В обычном состоянии йод – тёмно–серые кристаллы с металлическим блеском. В таком виде его можно расплавить, нагрев до температуры 133,5°С.
Кристаллический йод в воде не растворяется, а в спирте растворяется хорошо. Спиртовой раствор йода имеет бурый цвет (он продаётся в аптеке в виде 5-10% раствора йода). Пары йода имеют тёмно-фиолетовый окрас.
Йод – прекрасное профилактическое средство против излучения. Его добавление к пище способствует укреплению щитовидной железы, которая больше всего подвержена радиоактивному влиянию. Для усвоения йода организмом в пищу используют йодированную соль (KI – йодид калия). Эту соль в виде добавок к пищевой соли (NaCl) можно приобрести в продуктовых магазинах.
Любопытно то, что реакционная способность йода в «разноцветных» растворах (фиолетовый и коричневый) – неодинакова. Так, в коричневых растворах йод намного активнее, чем в фиолетовых, например быстрее реагирует с медью. Это объясняется тем, что молекулы йода могут взаимодействовать с молекулами растворителя, образуя комплексы, в которых йод более активен. Именно растворитель играет решающую роль в проявлении активности йода!
При добавлении растительного масла к раствору йода можно наблюдать переход йода из водной фазы в органическую (экстракцию). Процесс экстракции заметно ускорится, если смесь энергично встряхивать.
Кое-что о пользе йода:
Йод – один из очень важных элементов для организма человека. Нормальная доза для потребления его человеком исчисляется в микрограммах, но его отсутствие в организме – опасно для жизни человека. Йод принимает участие в синтезе гормонов щитовидной железы, которые в свою очередь отвечают за нормальный рост и развитие человеческого организма; йод очень необходим для правильной работы мозга!
Химические свойства водорода
С точки зрения свойств водорода как простого вещества, он, все-таки, имеет больше общего с галогенами. Водород, также как и галогены, является неметаллом и образует аналогично им двухатомные молекулы (H2).
В обычных условиях водород представляет собой газообразное, малоактивное вещество. Невысокая активность водорода объясняется высокой прочностью связи между атомами водорода в молекуле, для разрыва которой требуется либо сильное нагревание, либо применение катализаторов, либо и то и другое одновременно.
Взаимодействие водорода с простыми веществами
с металлами
Из металлов водород реагирует только с щелочными и щелочноземельными! К щелочным металлам относятся металлы главной подгруппы I-й группы (Li, Na, K, Rb, Cs, Fr), а к щелочно-земельным — металлы главной подгруппы II-й группы, кроме бериллия и магния (Ca, Sr, Ba, Ra)
При взаимодействии с активными металлами водород проявляет окислительные свойства, т.е. понижает свою степень окисления. При этом образуются гидриды щелочных и щелочноземельных металлов, которые имеют ионное строение. Реакция протекает при нагревании:
Следует отметить, что взаимодействие с активными металлами является единственным случаем, когда молекулярный водород Н2 является окислителем.
с неметаллами
Из неметаллов водород реагирует только c углеродом, азотом, кислородом, серой, селеном и галогенами!
Под углеродом следует понимать графит или аморфный углерод, поскольку алмаз — крайне инертная аллотропная модификация углерода.
При взаимодействии с неметаллами водород может выполнять только функцию восстановителя, то есть только повышать свою степень окисления:
Взаимодействие водорода со сложными веществами
с оксидами металлов
Водород не реагирует с оксидами металлов, находящихся в ряду активности металлов до алюминия (включительно), однако, способен восстанавливать многие оксиды металлов правее алюминия при нагревании:
c оксидами неметаллов
Из оксидов неметаллов водород реагирует при нагревании с оксидами азота, галогенов и углерода. Из всех взаимодействий водорода с оксидами неметаллов особенно следует отметить его реакцию с угарным газом CO.
Смесь CO и H2 даже имеет свое собственное название – «синтез-газ», поскольку из нее в зависимости от условий могут быть получены такие востребованные продукты промышленности как метанол, формальдегид и даже синтетические углеводороды:
c кислотами
С неорганическими кислотами водород не реагирует!
Из органических кислот водород реагирует только с непредельными, а также с кислотами, содержащими функциональные группы способные к восстановлению водородом, в частности альдегидные, кето- или нитрогруппы.
c солями
В случае водных растворов солей их взаимодействие с водородом не протекает. Однако при пропускании водорода над твердыми солями некоторых металлов средней и низкой активности возможно их частичное или полное восстановление, например:
Хлор
Типичными неметаллами являются газы. Они не проявляют при нормальных условиях ни одного сходного с металлами свойства.
Элемент хлор (Сl2). При нормальных условиях хлор – это желтовато–зелёный газ с резким удушливым запахом. Хлор очень ядовит даже при такой малой концентрации как 0,001 мг на 1 дм3 воздуха. Этот газ в 2.5 раза тяжелее воздуха, поэтому всегда будет находится у самой земли в виде желтовато-зелёного тумана.
При содержании хлора в воздухе 0,9 мл/л смерть наступает в течение пяти минут. В небольших количествах (человек чувствует хлор уже при концентрации его в воздухе 0,003 мл/л), он сильно раздражает слизистые оболочки дыхательных путей и вызывает кашель.
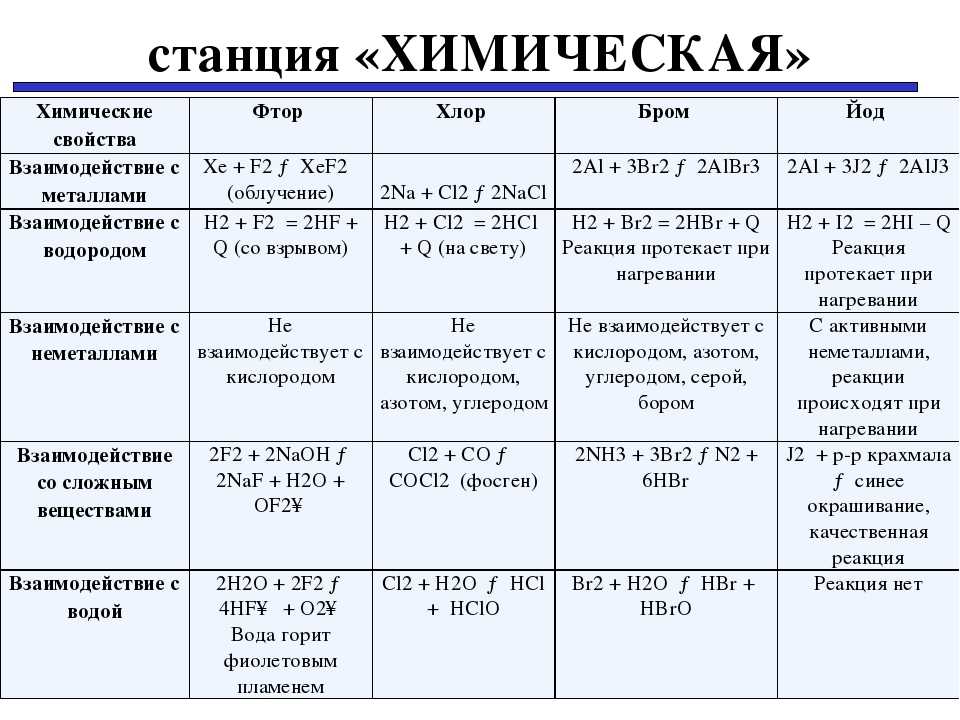
Хлор напрямую не взаимодействует с кислородом, азотом, углеродом и инертными газами. Окислительные свойства хлора проявляются в реакциях с простыми веществами (металлическим натрием Na, железом Fe, фосфором P, серой S) и некоторыми сложными веществами.
Хлор содержится в земной коре по массе 0,017%. В некоторых горных районах он покрывает основание грунта и потому приводит к гибели насекомых, мелких грызунов и микроорганизмов. Температура кипения хлора равна (- 33,6 °С), а температура плавления (-100,98 °С).
Хлор относится к ряду галогенов (фтор F2, хлор Cl2, бром Br2, йод I2, астат At2 ), что придаёт ему некоторые особенности в химических реакциях. В реакциях с другими галогенами он вытесняет любой из галогенов, стоящих после него (бром, йод и астат).
Газообразный хлор отлично растворяется в холодной воде, 1 объём воды растворяет около 2 объёмов хлора с образованием двух кислот: соляной кислоты (HCl) и хлорноватистой (HClO), последняя не стойкая и распадается на атомарный кислород и соляную кислоту. Полученная кислота является одной из сильных кислот.
Хлор имеет прекрасное дезенфицирующее свойство. Он уничтожает практически все живые организмы в сфере своего влияния, что делает его полезным в медицине и домашнем хозяйстве (порошки, хлорка – то же хлорная вода, соды с содержанием хлора). Сухой хлор такой способности не имеет. Раствор хлора в воде носит название «хлорной воды» которая имеет прекрасное свойство отбеливания материалов (тканей, дерева, бумаги и т.д.). Раствор хлора «уничтожает» краску на одежде, поэтому если не хотите, чтобы ваша кофточка или рубашка покрылась белыми пятнами – не используйте такую воду при стирке цветного белья. Достаточно просто поместить влажную крашенную ткань в струю хлора, как вскоре она потеряет свой цвет и превратится в чисто-белую.
Как хлорная вода влияет на волосы при купании например в бассейне (можно ознакомиться на странице ).
Получение хлора
Хлор – ядовитый газ, тяжелее воздуха, поэтому при реакции будет скапливаться на дне колбы
Для проведения химической реакции нам понадобится и соляная кислота.
В одну колбу насыпьте немного перманагната калия, присоедините к этой колбе трубку для отвода хлора, который выделится при реакции с марганцовки с соляной кислотой. Другой конец трубки опустите в пустую колбу (её желательно накрыть крышкой (чтобы случайно не вдохнуть!). Желательна такая конструкция, как на картинке слева. Если всё готово, приступим:
Прилейте соляную кислоту к марганцовке. Наблюдайте выделение жёлто-зелёного газа – это хлор. Реакция протекает следующим образом:
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8H2O
Вещества, которые образуются при реакции (кроме хлора) – 2 соли – хлорид калия KCl и хлорид марганца MnCl2, а также вода.
Краткая характеристика соединений брома и йода
Чтобы начать рассмотрение различий, нужно обратить внимание на характеристику каждого из элементов. Только после сравнения будет наглядно видна разница между ними. Для того чтобы определить основное отличие рассматриваемых веществ, рекомендуется рассмотреть их основные свойства
Для того чтобы определить основное отличие рассматриваемых веществ, рекомендуется рассмотреть их основные свойства.
Бром обозначается в периодической таблице, как Br. Атомный номер (число, по которому можно найти) — 35.
В обычных условиях, при комнатной температуре и без нагревания или охлаждения вещество имеет коричнево-красный оттенок. Представляет собой жидкость.
Особенность брома состоит в том, что этот химический элемент хотя и относится к группе неметаллов, но когда температура комнатная, он находится в жидком агрегатном состоянии.
Особенности, которые необходимо учитывать:
- галогенид;
- имеет неприятный запах;
- пары коричневого цвета.
Галогены инфографика
Молекула обозначается в формулах, как Br₂ . Если сравнивать его с йодом, то с химической точки зрения этот металл является более активным, чем йод. Одновременно он уступает по этому показателю таким веществам, как хлор или фтор (или соединениям, таким как фторид).
Бром — вещество природного происхождения. Месторождения имеются в Китае или Америке.
С помощью электролиза можно извлечь бром из солевых отложений. Это первое вещество, которое удалось получить из морской воды.
Теперь нужно разобраться с тем, что представляет собой молекула йода и вещество в целом. Объединяет его с бромом то, что элемент является галогеном. Атомный номер — 53.
Нужно обратить внимание на то, что вещество находится в твердом состоянии при нормальных условиях (комнатной температуре и обычном давлении). Йод относится к группе неметаллов. Важен тот факт, что вещество представляет собой кристалл
Цвет черный с характерным блеском
Важен тот факт, что вещество представляет собой кристалл. Цвет черный с характерным блеском.
Если же происходит нагрев и последующее кипение, элемент преобразуется. Возникает пар, который имеет фиолетовый оттенок. В воде йод и его соединения растворяется плохо, но достаточная активность проявляется при взаимодействии с неполярными растворителями, такими, как, например, гексан.

Йод в привычном виде
Факторы, влияющие на скорость реакции брома и иода с металлами
1. Размер иона металла. Чем меньше ион металла, тем быстрее происходит реакция. Это связано с тем, что маленькие ионы металла имеют большую электроотрицательность и могут легче образовывать связи с атомами брома или иода.
2. Энергия активации. Реакция брома и иода с металлами происходит при повышенных температурах, так как энергия активации для этих реакций высока. Чем выше температура, тем больше энергии доступно молекулам для преодоления активационного барьера и более быстрая реакция.
3. Концентрация реагентов. При повышении концентрации брома или иода, а также металла, увеличивается количество молекул, способных к реакции. Это приводит к увеличению частоты столкновений и, соответственно, к повышению скорости реакции.
4. Физическое состояние реагирующих веществ. Взаимодействие брома и иода с металлами может происходить в разных физических состояниях – в растворе, в твердой фазе или в газообразной фазе. В каждом из случаев скорость реакции будет различной, так как разные состояния обладают разными свойствами и позволяют различным частям молекул вступать во взаимодействие.
5. Специфика реагирующих металлов. Различные металлы могут иметь разную реакционную активность с бромом и иодом. Это обусловлено различием в структуре и свойствах атомов металла. Например, металлы с более низкой электроотрицательностью могут образовывать более сильные связи с бромом или иодом, что ускоряет реакцию.
6. Присутствие катализаторов. Некоторые вещества, называемые катализаторами, могут ускорять реакцию брома и иода с металлами. Они понижают энергию активации реакции, образуя промежуточные соединения, которые затем разлагаются, ускоряя ход реакции.
Все эти факторы оказывают влияние на скорость реакции брома и иода с металлами и позволяют управлять этими реакциями, например, для ускорения или замедления процесса в зависимости от требуемых условий.
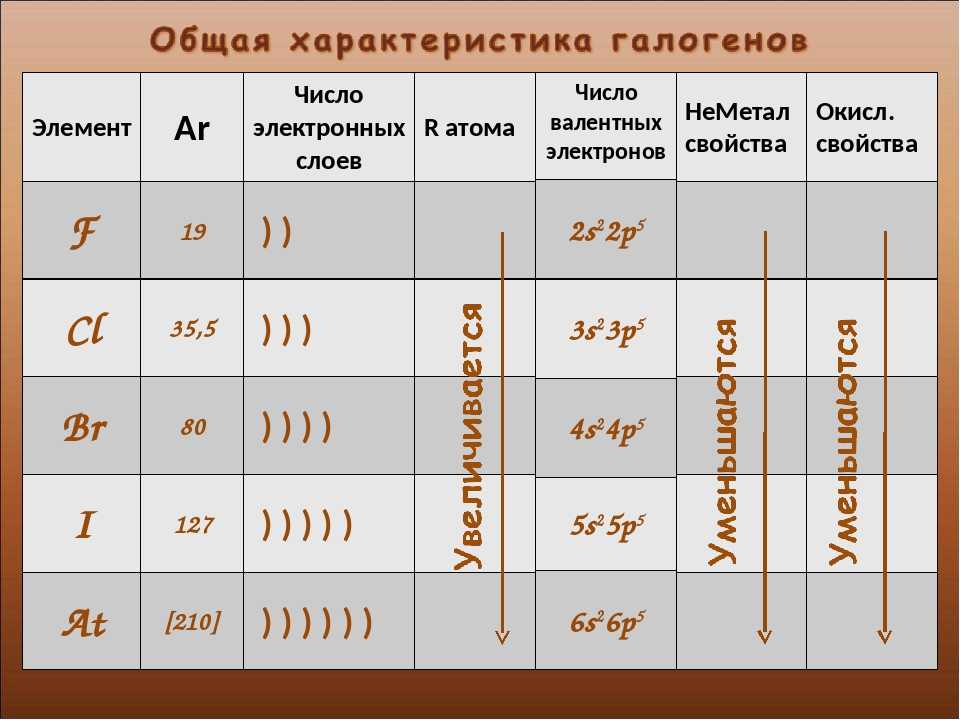
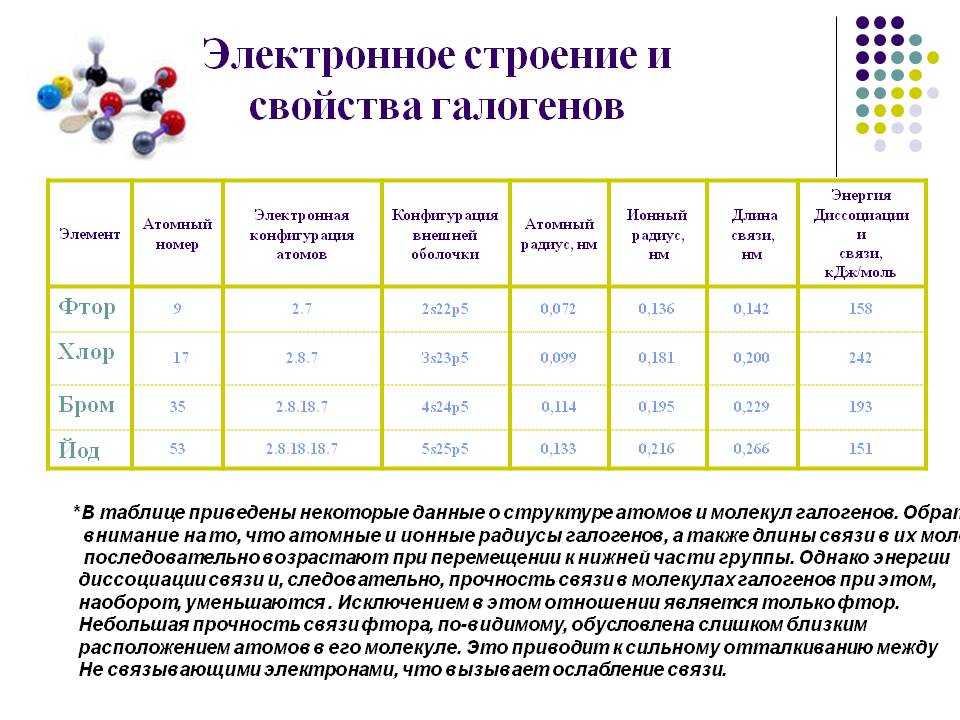
Часть 3. Электронное строение атомов 7А-подгруппы
В зависимости от положения элемента в ПС меняется его электронное строение. Рассмотрим электронное строение атомов фтора, хлора, брома и йода.
F: 1s(2) 2s(2) 2p(5)
Cl: 1s(2) 2s(2) 2p(6) 3s(2) 3p(5)
Br: 1s(2) 2s(2) 2p(6) 3s(2) 3p(6) 3d(10) 4s(2) 4p(5)
I: 1s(2) 2s(2) 2p(6) 3s(2) 3p(6) 3d(10) 4s(2) 4p(6) 4d(10) 5s(2) 5p(5)
Так как все галогены находятся в 7А-подгруппе и исходя из их электронного строения можно заметить, что их валентные оболочки имеют идентичное строение, а значит и одинаковое количество электронов на них. Тогда запишем общую формулу электронного строения рассматриваемых нами галогенов, в основном опираясь на интересующие нас валентные электроны, так как именно они будут задействованы в химических реакциях.
Hal: ns(2) np(5)
Где Hal-галоген, а n-порядковый номер валентного подуровня.
Обратим внимание, что всем галогенам не хватает лишь 1 электрона для устойчивой 8-электронной конфигурации, поэтому принято считать, что объединяясь с металлами они связываются ионную связью, образуя соли. К слову, и само название “галоген” означает “рождающий соли”
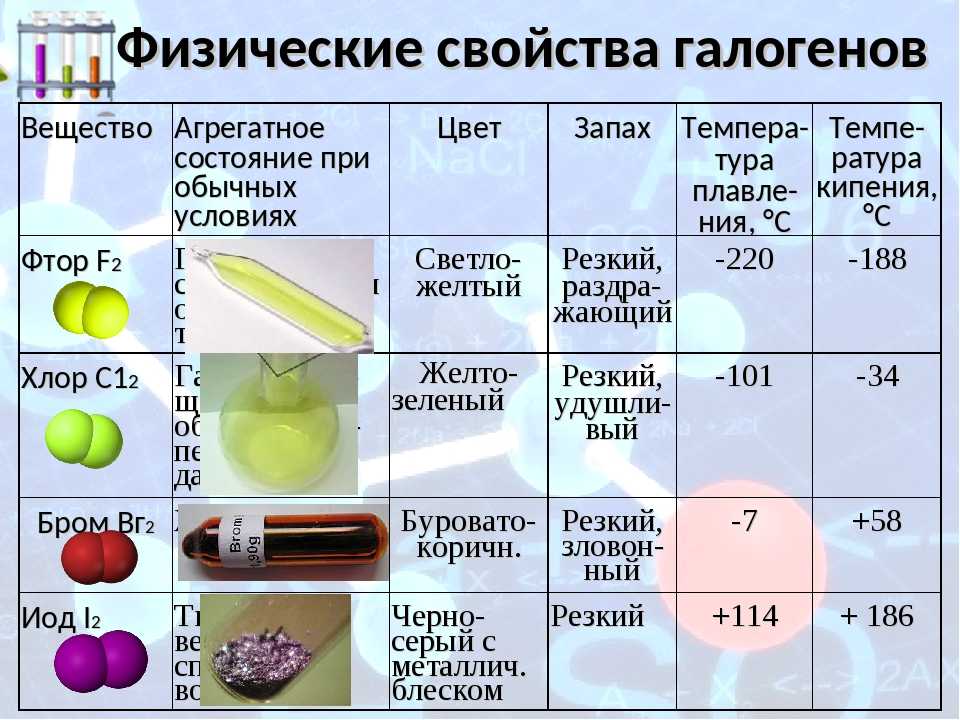
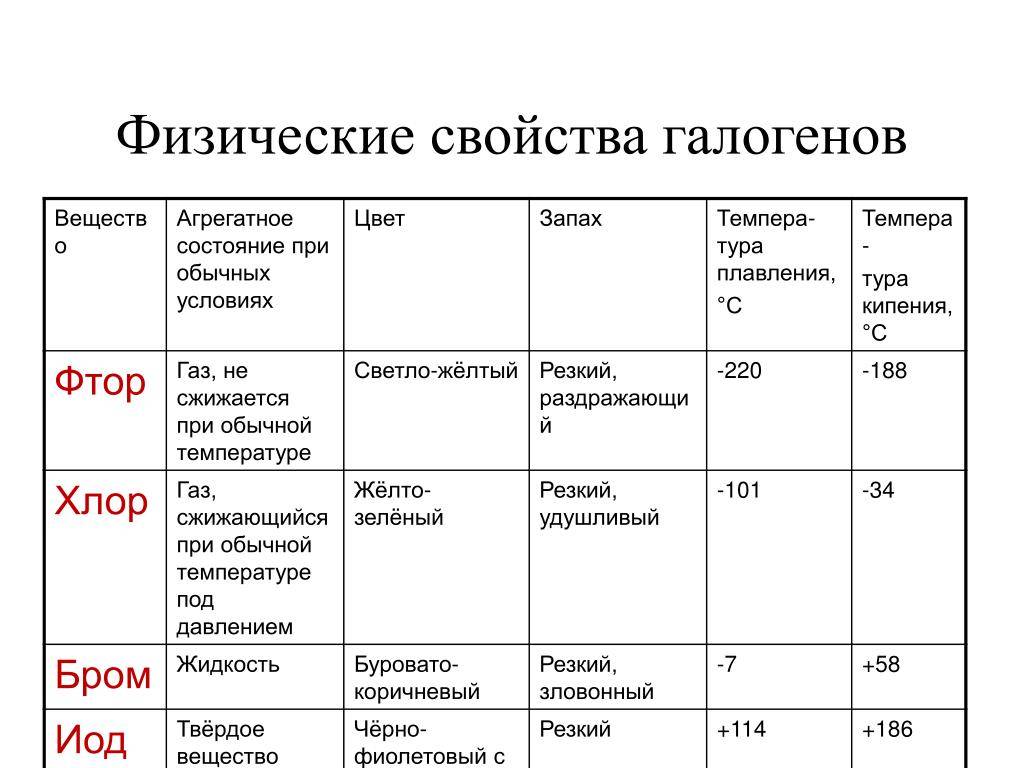
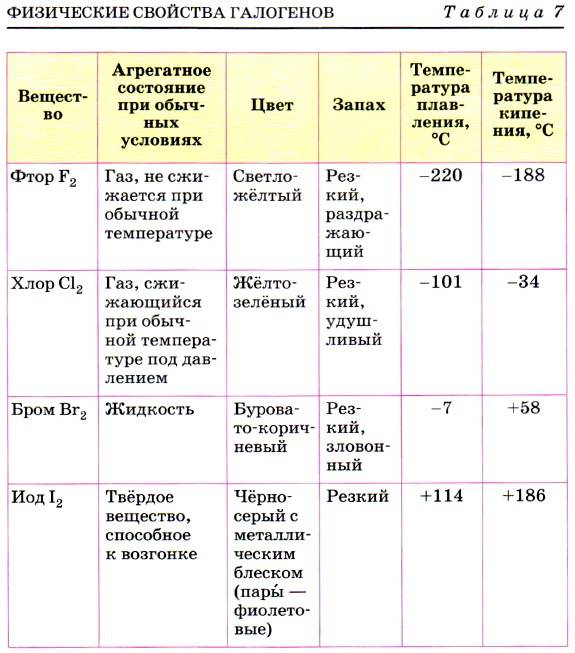
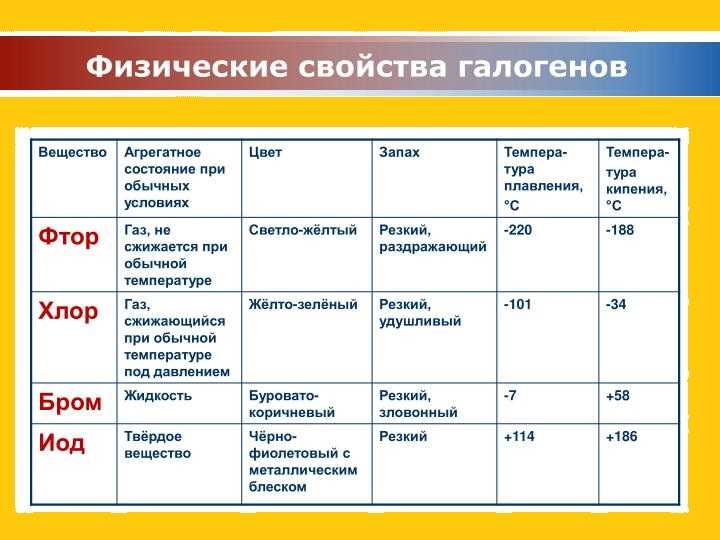
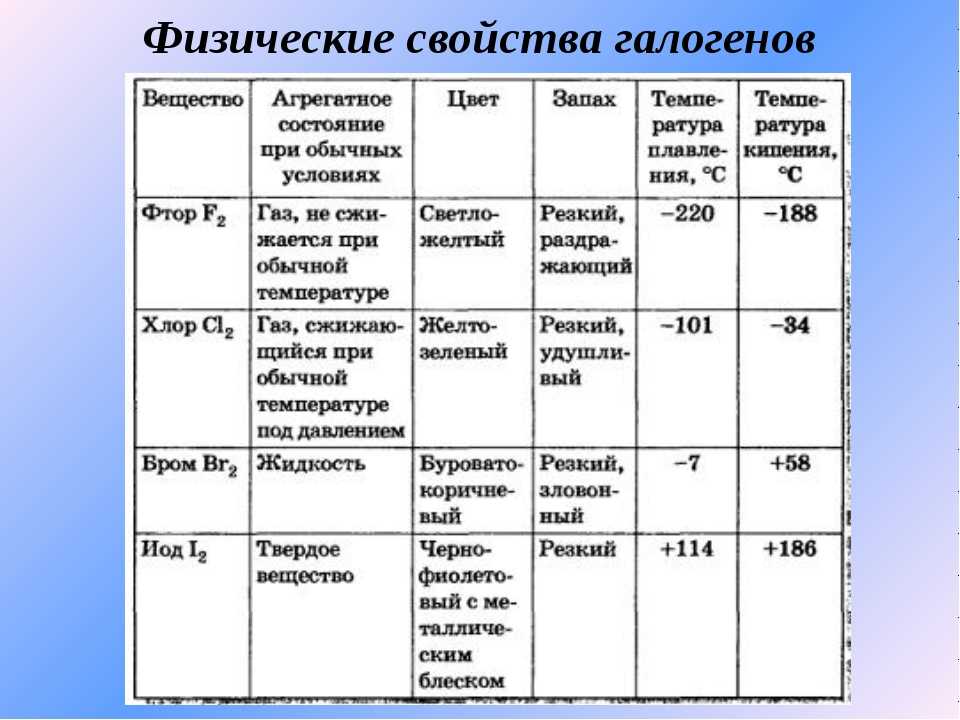
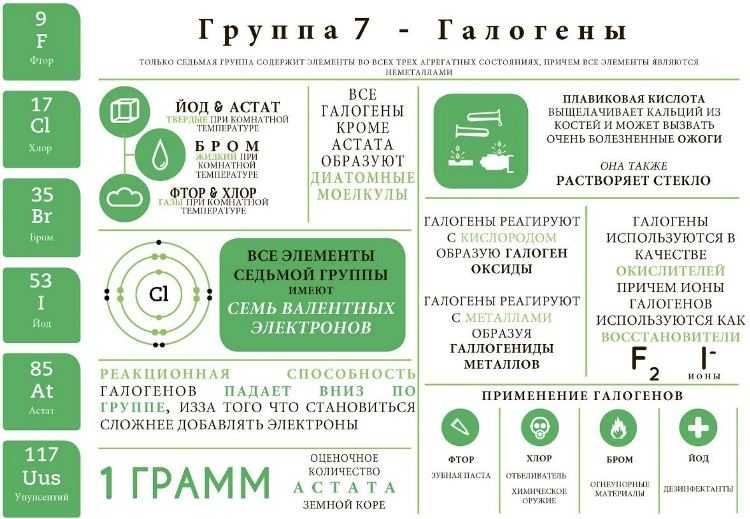
Физические свойства галогенов
Рассматривая вещества, нужно обратить внимание на физическое состояние и свойства этой химической группы элементов. В ходе исследований стало известно, что галогены способны сохранять первоначальное молекулярное строение во всех агрегатных состояниях (жидкость, газ, твердый элемент). Их активность во взаимодействии с другими веществами достаточно высокая
Их активность во взаимодействии с другими веществами достаточно высокая.
Галогены — простые вещества, имеющие несложный молекулярный состав (2 атома с ковалентной неполярной связью). Формулы, соответственно, пишутся следующим образом:
- Cl₂.
- F₂.
- I₂.
- Br₂.
Заряд ядра равен порядковому номеру элемента в периодической таблице Менделеева. Вещества проявляют способность к кипению и плавлению. Свойственна им и электропроводимость. Но рассматриваемая группа веществ плохо проводит электричество и тепло.
Их электроотрицательность постепенно снижается с возрастанием порядкового номера.
Нужно также обратить внимание и на то, какой кристаллический рисунок имеют вещества этой группы. Галогены обладают интересной решёткой. Атомы в количестве 2-х единиц, содержат на внешнем энергетическим уровне 7 электронов
Эти вещества способны окислять, так как до завершения уровня им не хватает всего 1-го электрона
Атомы в количестве 2-х единиц, содержат на внешнем энергетическим уровне 7 электронов. Эти вещества способны окислять, так как до завершения уровня им не хватает всего 1-го электрона.
В результате окислительные свойства выраженные и достаточно яркие. Именно по этой причине в природе в чистом виде эти вещества встречаются крайне редко. Встретить галогены можно в составе разнообразных солей. Нужно отметить, что реакция с кислотами, в состав которых включены рассматриваемые элементы, возрастает с увеличением показателей их атомной массы.

Некоторые галогены встречаются крайне редко
Также к физическим свойствам следует отнести характерный резкий и достаточно неприятный запах. Растворимость в воде плохая, токсичность высокая (пример: хлор).
Особенностью является тот факт, что с увеличением показателей атомной массы окраска галогена становится более насыщенной и темной. По этой же причине возрастает температура, которая требуется для начала плавления и кипения.
Вдыхать испарения нельзя. Работать с веществами из этой группы рекомендуется в защите (глаза, руки, органы дыхания).
Применение в промышленности
Бром и йод широко используются в различных отраслях промышленности благодаря своим уникальным свойствам и характеристикам.
Бром
- Бромистый огонь, получаемый путем сжигания брома, используется в фотографии и киноиндустрии для создания эффектов дыма и пожара.
- Бром применяется в производстве огнезащитных средств, таких как огнезащитные краски и покрытия, которые защищают материалы от возгорания.
- Бромные соединения используются в процессе получения полимеров, таких как пластмассы и синтетические волокна.
- Бром содержится в многих химических реагентах, применяемых в лабораторных исследованиях и анализе.
Йод
Йод используется в медицинской промышленности для производства антисептических растворов, таких как йодированный спирт и йодированное масло. Йод используется в производстве фоточувствительных материалов для фотографии. Йод является важным компонентом в производстве красителей, лекарственных препаратов и косметических средств
Йод применяется в процессе получения органических соединений, таких как йодоорганические соединения, которые имеют важное значение в фармацевтической и агрохимической промышленности
Оба вещества также могут использоваться в процессах очистки воды и в производстве электроники и полупроводников. Их применение в промышленности зависит от их химических свойств и потенциальных преимуществ в конкретной области.