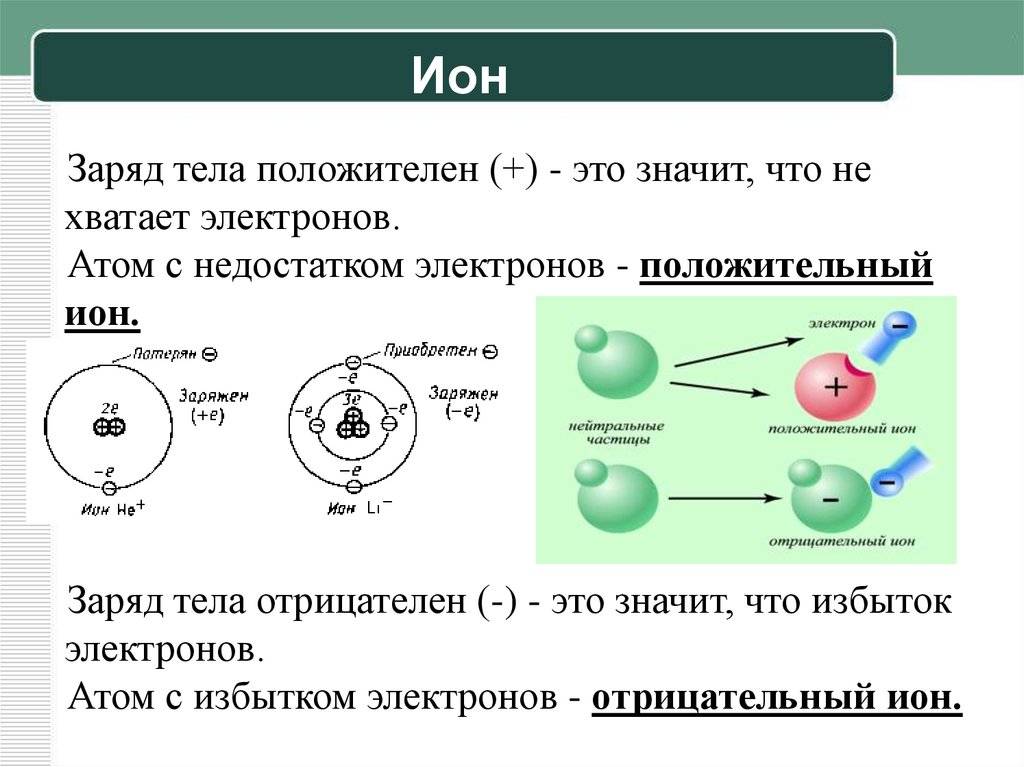
Влияние ионов и атомов на окружающую среду: биологическая и экологическая роль
Ионы и атомы играют важную роль в окружающей среде, существенно влияя на биологические и экологические процессы. Благодаря своим электрическим свойствам и молекулярной структуре, они участвуют во многих химических реакциях и обеспечивают необходимые условия для жизни на Земле.
Ионы и атомы играют важную роль в процессе питания растений и животных. Ионы, такие как нитраты и фосфаты, являются основными элементами питания, необходимыми для роста и развития растений. Они входят в состав макроэлементов, таких как азот и фосфор, и способствуют накоплению и использованию энергии. Эти ионы передаются через почву и воду, попадая в пищевую цепочку и обеспечивая питательные вещества для растений, животных и человека.
Вода, состоящая из ионов гидрооксидов и гидрониев, играет важную роль в биологических процессах. Ионы водорода влияют на кислотно-щелочной баланс в организмах и участвуют в регулировании рН среды, что необходимо для нормального функционирования живых систем.
Ионы металлов, такие как железо, медь и цинк, являются важными микроэлементами для многих организмов. Они участвуют в биохимических реакциях, обеспечивают функционирование ферментов и других белков, а также играют роль в иммунной системе. Однако, при избыточном количестве этих ионов они могут иметь токсический эффект на организмы и вызывать серьезные проблемы для здоровья и экологического баланса.
Атомы и ионы также влияют на экологические процессы в природе. Они участвуют в геохимических циклах, таких как углеродный цикл, азотный цикл и фосфорный цикл. Эти циклы осуществляют передвижение ионообмена и важны для обеспечения биологического разнообразия и устойчивости экосистем. Например, углеродные ионы переносятся через атмосферу, растения, животных и грунт, играя важную роль в процессах фотосинтеза, дыхания и декомпозиции органических веществ.
Таким образом, ионы и атомы оказывают существенное влияние на окружающую среду, способствуя биологическим и экологическим процессам. Они являются основными элементами питания и участвуют во многих химических реакциях, обеспечивая необходимые условия для жизни на Земле
Это напоминает нам о важности бережного отношения к окружающей среде и ее ресурсам, чтобы сохранить баланс и устойчивость природы
Классификация
Ионы делятся на две группы:
- простые или моноатомные – содержат одно ядро, т.е. состоят из одного атома вещества;
- сложные или полиатомные – содержат минимум два ядра, т.е. состоят из двух и более атомов вещества.
К простым ионам относятся катионы и анионы металлов и неметаллов – Na+, Mg2+, Cl–. Сложные ионы образуются при присоединении иона к нейтральным молекулам вещества. Например:
- NH3 + H+ → NH4+;
- BF3 + F– → BF4–.
Катионами являются ионы металлов, водорода, аммония и некоторых других веществ. Анионами являются гидроксид-ион (OH–), ионы кислотных остатков, неметаллов и других веществ.
Некоторые атомы могут становиться катионами или анионами в зависимости от реакции.
Также выделяют ион-радикалы – свободные заряженные частицы, способные присоединять атомы или присоединяться к атомам других веществ. В зависимости от заряда делятся на китионы-радикалы и анионы-радикалы.
Ионная связь – класс соединения ионов. Ионная связь возникает в результате электростатического притяжения анионов и катионов. При этом атом с большей электроотрицательностью притягивает атом с меньшей электроотрицательностью. Ионная связь возникает преимущественно между ионами металлов и неметаллов. Металл всегда отдаёт электроны, т.е. является восстановителем.
Рис. 3. Схема ионной связи.
Что мы узнали?
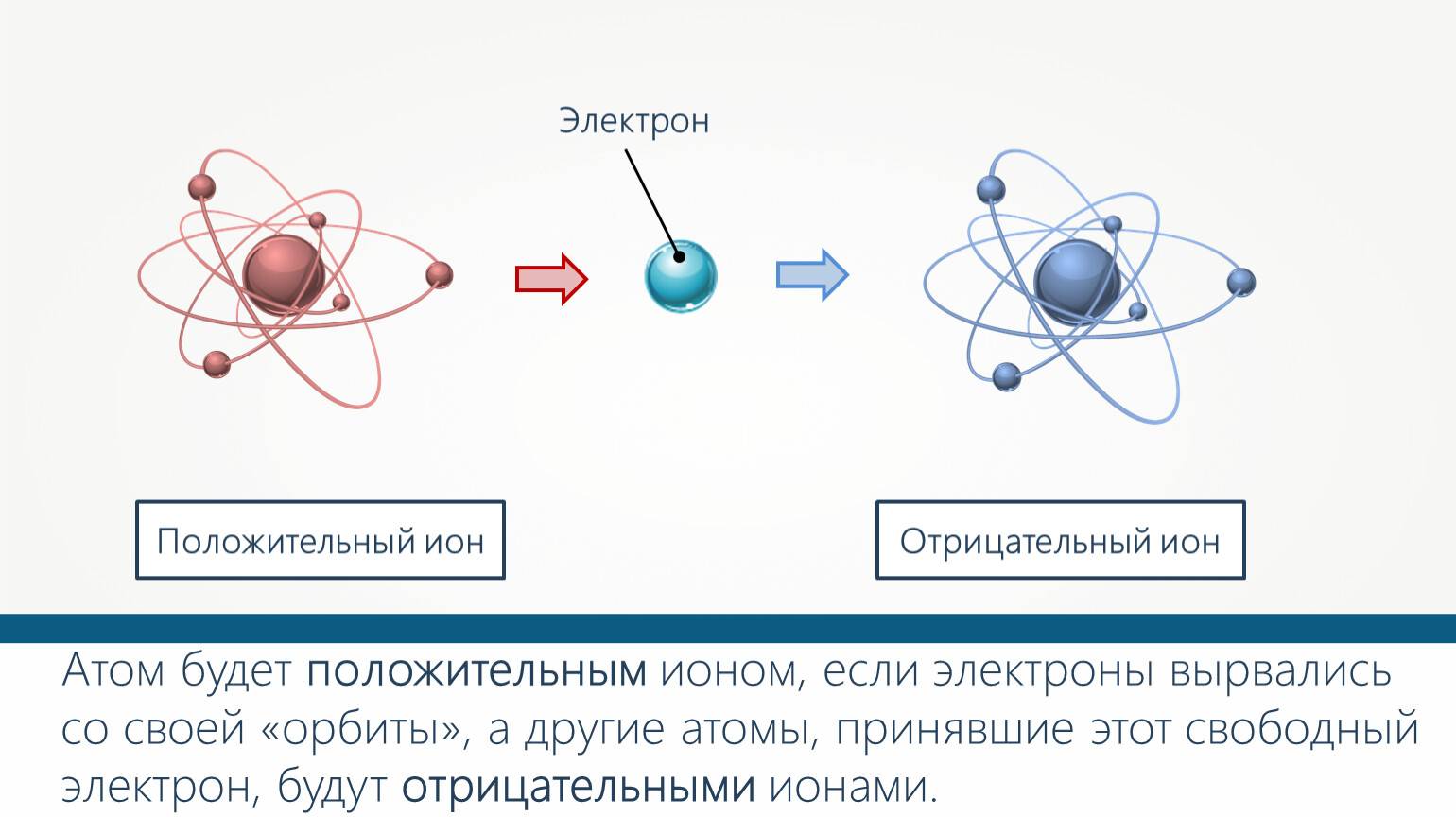
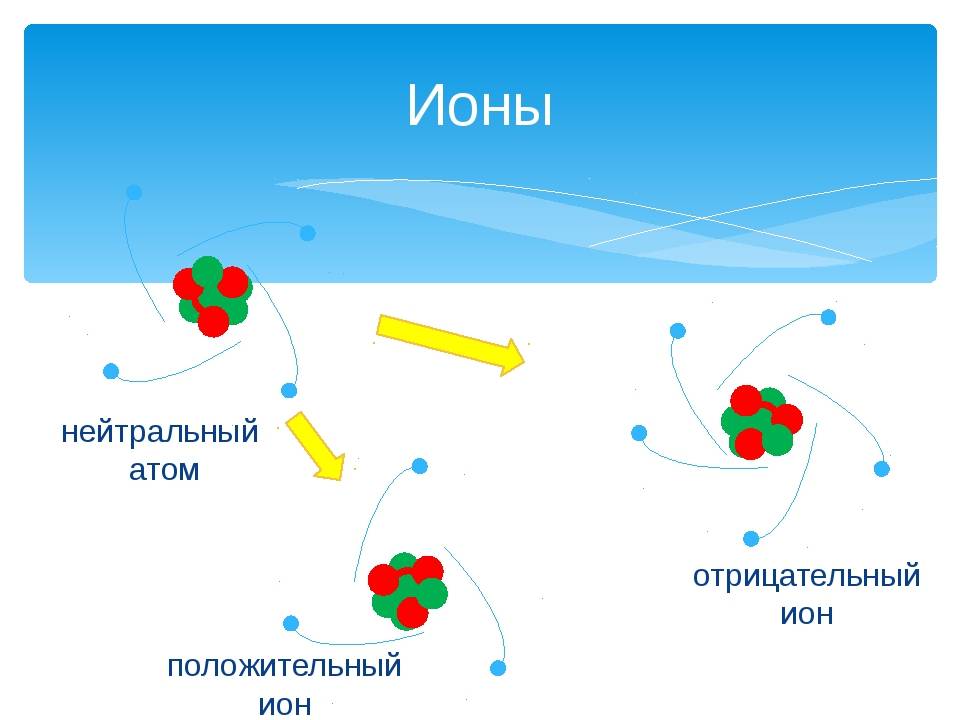
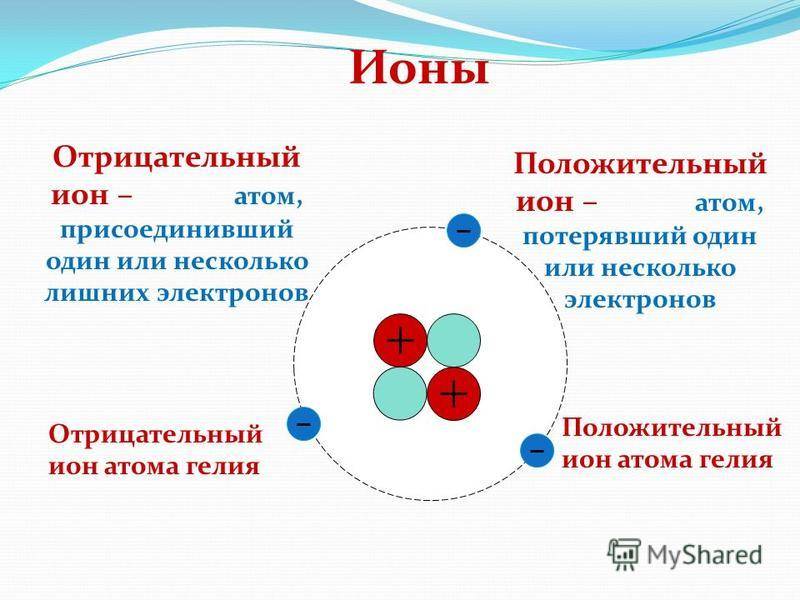
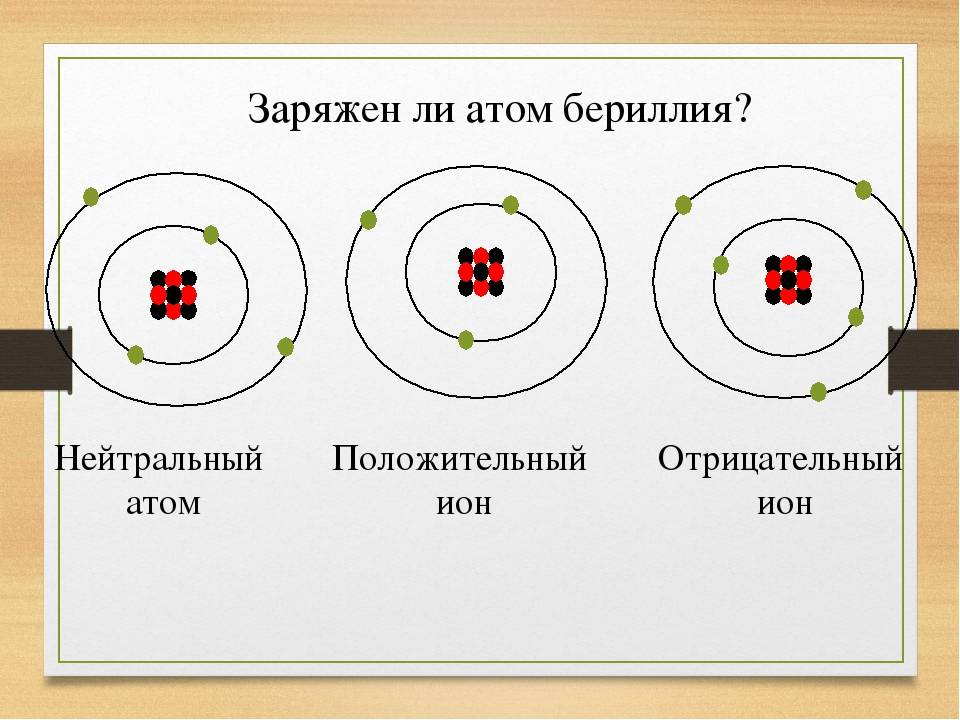
Из темы урока узнали, что такое ионы. Атом становится ионом при отщеплении или присоединении электронов. Если электронов становится меньше, то атом приобретает положительный заряд за счёт преобладания протонов и становится катионом. При увеличении количества отрицательно заряженных электронов атом становится анионом. Ионы способны передавать электричество и обязательно присутствуют в электролитах. Между ионами возникает ионная связь за счёт электростатического притяжения отрицательных и положительно заряженных частиц.
/10
Вопрос 1 из 10
Что такое ион?
- Частица, в которой преобладает количество электронов
- Частица, в которой преобладает количество протонов
- Частица, в которой содержится разное число протонов и электронов
- Нейтральная частица
Сравнение
Атом всегда электрически нейтрален, ион, напротив, заряженная частица. У атомов внешние энергетические уровни, как правило, не завершены (исключением является группа благородных газов). У ионов же внешние уровни завершены.
Ион в противоположность атому не способен обладать свойствами простого вещества. Например, металлический калий вступает в бурную реакцию с водой, продуктами которой становится водород и щелочь. А ионы калия, имеющиеся в составе солей калия, не обладают подобными свойствами. Хлор – желто-зеленый ядовитый газ, а его ионы не ядовиты и бесцветны.
Цвет меди – красный, а ее ионы в растворах приобретают голубую окраску. Кристаллы йода – серые, пары – фиолетовые, спиртовой раствор – красно-бурого цвета, в смеси с крахмалом он дает синее окрашивание. Ионы йода не могут изменить окраску крахмала, они бесцветны.
- Атомы и ионы одного химического элемента имеют разное количество электронов.
- Заряд атомов равен нолю, у ионов он может быть положительным или отрицательным.
- Ионы и атомы обладают различными окислительно-восстановительными свойствами.
(10 оценок, среднее: 3,60 из 5)
Массы трех фундаментальных частиц, выраженные в а.е.м., имеют следующие значения: масса протона – 1.007277 а.е.м., масса нейтрона – 1.008665 а.е.м., масса электрона – 0.000548 а.е.м. Указывать массу электрона 0- принципиальная ошибка,вводит учеников в дальнейшие заблуждения.
Где “ровно ноль”? В тексте сказано “ПОЧТИ ноль” и уточнено – в 1836 раз меньше массы протона. Многие и “почти ноль” не желают знать и помнить.
Цитаты: Свойства электрона: масса 0 и заряд –1. Протон Электрон Нейтрон Масса 1 0 1
Так и пишите”почти 0″ или ставьте знак приближенного равенства.
Портал Проза.ру предоставляет авторам возможность свободной публикации своих литературных произведений в сети Интернет на основании пользовательского договора. Все авторские права на произведения принадлежат авторам и охраняются законом. Перепечатка произведений возможна только с согласия его автора, к которому вы можете обратиться на его авторской странице. Ответственность за тексты произведений авторы несут самостоятельно на основании правил публикации и законодательства Российской Федерации. Данные пользователей обрабатываются на основании Политики обработки персональных данных. Вы также можете посмотреть более подробную информацию о портале и связаться с администрацией.
Все права принадлежат авторам, 2000-2022. Портал работает под эгидой Российского союза писателей. 18+
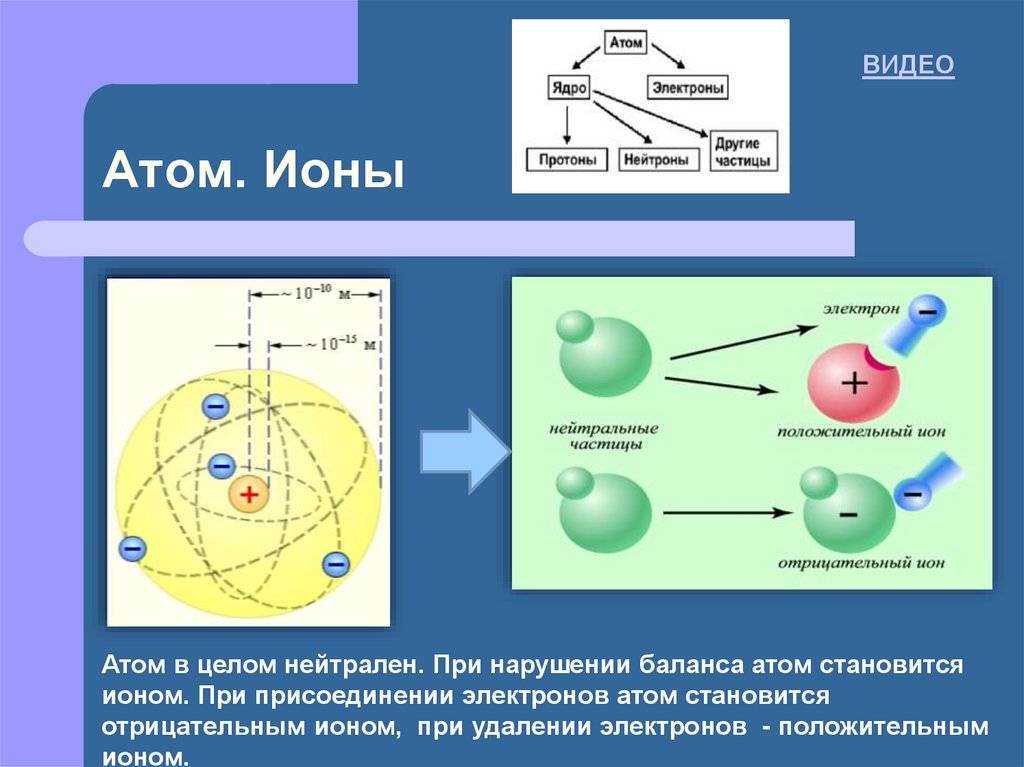
Атомы и ионы – микроскопические частицы, которые состоят из ядра и электронов, вращающихся вокруг него по орбиталям. Основное, но не единственное, отличие между этими частицами состоит в том, что ион несет определенный заряд, а атом – нет.
Строение атома
Великие ученые и философы древности упорно бились над вопросом, из чего же состоят вещества, которые их окружают. Впервые идею о том, что все тела живой и неживой природы состоят из мельчайших частиц — атомов — высказал древнегреческий ученый Демокрит целых 2500 лет назад!
Что же из себя представляет атом?
Атом — это мельчайшая химически неделимая частица вещества.
| Можно ли увидеть атом?Поскольку атомы невероятно малы по сравнению с длиной волны видимого света, их нельзя наблюдать даже с самым мощным в мире оптическим микроскопом. Вот почему ученые используют микроскоп другого типа, известный как сканирующий туннельный микроскоп. Он может обеспечить боковое разрешение 0,1 нм и разрешение по глубине 0,01 нм, что достаточно для изображения отдельных атомов в материалах. |
Атомы могут соединяться друг с другом с помощью химических связей в различной последовательности, образуя более сложные частицы — молекулы.
Можно провести аналогию: атом — это отдельный человек, а молекулы — группы людей, объединенные общим признаком (семья, одноклассники, коллеги, любители кошек, любители собак).
Молекулы — это мельчайшие частицы, которые состоят из атомов. Они являются химически делимыми.
Долгое время считалось, что атом нельзя разделить далее на составляющие. Но с развитием науки ученые-физики выяснили, что атом состоит из более мелких, или элементарных частиц — протонов (p), нейтронов (n) и электронов (ē). В центре атома располагается ядро, которое состоит из протонов и нейтронов (их общее название нуклоны), а вокруг ядра вращаются электроны.
Электроны являются элементарными частицами, то есть неделимыми мельчайшими частицами. Протоны и нейтроны состоят из более мелких кварков, однако в рамках школьной программы кварки не рассматриваются, поэтому протоны и нейтроны мы также относим к элементарным частицам.

Каждая из элементарных частиц в атоме имеет свой заряд и массу.

| Чем атом похож на Солнечную систему?Можно представить атом как Солнечную систему, где вокруг ядра (Солнца) по орбитам вращаются электроны (планеты). Это так называемая планетарная модель атома. Планетарная модель наглядно описывает расположение элементарных частиц относительно друг друга, но не учитывает законы квантовой физики, а также не объясняет устойчивость атома. В реальности атом намного сложнее, но для запоминания нам удобнее пользоваться именно планетарным представлениями. |

Тогда более точно определение атома будет звучать так.
Атом — электронейтральная химически неделимая частица, которая состоит из положительно заряженного ядра и вращающихся вокруг него отрицательно заряженных электронов.
Перейдем от теоретической информации к практической и научимся определять количество элементарных частиц в заданном атоме. Этот навык очень пригодится нам при решении заданий первой части!
Название ионов
Ионы металлов, которые имеют различные (переменные) степени окисления, записываются следующим образом:
- Fe2+ железо(II) или ион двухвалентного железа
- Fe3+ железо(III) или ион трехвалентного железа
- Сu+ медь(I) или ион одновалентной меди
- Cu2+ медь (II) или ион двухвалентной меди
- Sn2+ олово(II) или двухвалентного олова
- Sn4+ олово(IV) или ион четырехвалентного олова
Пример 2: Окисление или восстановление происходит при превращении иона трехвалентного железа в ион двухвалентного? Запишите уравнение этого процесса.
Решение: Уравнение реакции имеет следующий вид: Fe3+ + e— → Fe2+. Она представляет собой процесс восстановления, поскольку к исходному иону присоединяется электрон.
Надеюсь урок 6 «Простые ионы» оказался для вас понятным и полезным. Если у вас возникли вопросы, пишите их в комментарии.
Какой заряд будет у атома?
Теоретически возможно отобрать все электроны у атома, но это возможно только в лабораторных условиях и за
пределами лаборатории атомы в таком состоянии находиться не будут, почему?
Вернёмся к устройству электронной оболочки. Вокруг атома электроны сгруппированы по энергетическим уровням,
каждый заполненный уровень экранирует ядро и является более стабильным, нежели не до конца заполненный
уровень. То есть электронная конфигурация стремиться к состоянию заполненного подуровня: если на p-оболочке
находится 5 электронов, то вероятнее атом примет один электрон, нежели отдаст пять. Так, например, у атома
хлора, пять электронов на 3p-подуровне, энергия сродства хлора – 3.61 эВ, энергия ионизации – 13 эВ. У натрия
на последнем подуровне один электрон, энергия сродства – 0,78 эВ, потенциал ионизации – 0,49 эВ, поэтому
вероятнее натрий отдаст один электрон, нежели примет его.
Зная потенциал ионизации и энергию сродства мы можем сделать предположение о взаимодействии веществ. Если
смешать натрий и хлор, и сообщить им энергию, то вероятнее всего Na будет отдавать один электрон Cl и
в результате получится смесь ионов Na+ и Cl-.
Пример
Так можно по номеру элемента предположить, какой заряд он будет иметь, например, 19й элемент, электронная
конфигурация – 1s 22s 22p 63s 23p64s 1,
вероятнее всего, такой элемент может либо отдать, либо принять один электрон.
У 27го элемента электронная конфигурация выглядит так:
1s 22s 22p 63s 23p64s 23d7,
у d-подуровня всего может быть 10 атомов, т.е. либо атом примет 1,2 или 3 электрона, либо отдаст
1,2,3…7 электронов, так, вероятнее, он примет 3, т.е. возможные состояния – это +1, +2 и +3,
Теперь Вы знаете, что такое ионы, осталось изучить химическую связи и Вы сможете составлять
окислительно-восстановительные реакции!
Что такое атом?
Атом – это наименьшая возможная единица элемента. Атомы считаются основными строительными блоками материи, потому что они не могут быть разделены на более мелкие частицы никаким химическим процессом. Атомы считаются основными строительными блоками материи, потому что они не могут быть разделены на более мелкие частицы никаким химическим процессом.
Атом состоит из трех типов субатомных частиц: нейтронов, протонов и электронов. Нейтроны и протоны оба расположены в ядре атома; нейтроны являются нейтрально заряженными частицами, а протоны – положительно заряженными частицами. Электроны – это отрицательно заряженные частицы, которые вращаются вокруг ядра атома. Их расположение и движение являются основой многих химических свойств элемента.
Каждому типу атома присваивается атомный номер, который сообщает количество протонов в атоме. Обычно атом имеет одинаковое количество положительных частиц (протонов) и отрицательных частиц (электронов). Таким образом, число протонов идентично количеству электронов, и оба идентичны атомному номеру.
Атомы различных элементов
Атомы различных элементов отличаются друг от друга количеством протонов в ядре. Количество электронов может меняться, а протонов – никогда. Сколько протонов содержится в ядре, можно узнать по порядковому номеру элемента в периодической системе Менделеева. У водорода (№1) в состоянии покоя 1 электрон и 1 протон, у лития (№3) – 3 электрона и 3 протона, у углерода (№6) – 6 электронов и 6 протонов.
Поскольку количество протонов у различных атомов разное, массы у них тоже отличаются. Масса элемента в основном формируется протонами и нейтронами, ведь вес электронов ничтожно мал. Но даже у атомов одного и того же элемента вес может отличаться из-за разного количества нейтронов в ядре. Атомы, у которых количество нейтронов отличается от количества протонов, называют изотопами. Например, в природе существуют атомы углерода С12 (6 протонов и 6 нейтронов), С13 (6 протонов и 7 нейтронов) и другие разновидности с содержанием нейтронов от 2 до 16.
Чем отличаются понятия “атом” и “молекула”? и получил лучший ответ
Ответ от Sunriseатом меньше, в одной молекуле может быть несколько атомов (пример – 2 атома водорода и один атом кислорода= молекула воды)
Ответ от Диана Мамина
Молекула состоит из атомов.
Ответ от НЕТ
Кроме общих мест, ещё и родом.
Ответ от Воздушная
атом, это электронейтральная система взаимодействубщих элементов, состоящая из ядра и электронов. , а молекула – это соединение, состоящее из 2х или более атомов
Ответ от Durchlaucht Furst
А́том (др. -греч. ἄτομος – неделимый) – наименьшая часть химического элемента, являющаяся носителем его свойств. Атом состоит из атомного ядра и окружающего его электронного облака. Ядро атома состоит из положительно заряженных протонов и электрически нейтральных нейтронов, а окружающее его облако состоит из отрицательно заряженных электронов. Если число протонов в ядре совпадает с числом электронов, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом. Атомы классифицируются по количеству протонов и нейтронов в ядре: количество протонов определяет принадлежность атома некоторому химическому элементу, а число нейтронов – изотопу этого элемента.Атомы различного вида в различных количествах, связанные межатомными связями, образуют молекулы.Понятие об атоме как о наименьшей неделимой части материи было впервые сформулировано древнеиндийскими и древнегреческими философами (см. : атомизм). В XVII и XVIII веках химикам удалось экспериментально подтвердить эту идею, показав, что некоторые вещества не могут быть подвергнуты дальнейшему расщеплению на составляющие элементы с помощью химических методов. Однако в конце XIX – начале XX века физиками были открыты субатомные частицы и составная структура атома, и стало ясно, что атом в действительности не является «неделимым».Моле́кула (новолатинское molecula, уменьшительное от лат. moles – масса) – наименьшая частица вещества, несущая его химические свойства.Молекула состоит из двух или более атомов, характеризуется количеством входящих в неё атомных ядер и электронов, а также определённой структурой.Обычно подразумевается, что молекулы нейтральны (не несут электрических зарядов) и не несут неспаренных электронов (все валентности насыщены) ; заряженные молекулы называют ионами, молекулы с мультиплетностью, отличной от единицы (т. е. с неспаренными электронами и ненасыщенными валентностями) – радикалами.Молекулы, образованные сотнями или тысячами атомов, называются макромолекулами. Особенности строения молекул определяют физические свойства вещества, состоящего из этих молекул.
Ответ от Мариям Абдулла
еще у атомов электрический заряд, тогда как молекула нейтральна
Ответ от Мурват Казымов
атом это то из чего состоит молекула
Строение ионов и атомов: основные отличия
Строение ионов и атомов представляет собой несколько различных особенностей, которые определяют их химические и физические свойства.
| Атомы | Ионы | |
|---|---|---|
| Определение | Атомы являются основными строительными блоками вещества. У них нейтральное электрическое заряды. | Ионы — это заряженные частицы, образованные атомами путем добавления или удаления электронов. |
| Электрический заряд | Атомы имеют нейтральный электрический заряд, так как количество электронов равно количеству протонов в ядре. | Ионы имеют положительный или отрицательный заряд, в зависимости от количества добавленных или удаленных электронов. Положительные ионы называются катионами, а отрицательные ионы — анионами. |
| Размер ионов | Атомы имеют определенный радиус, который может варьироваться в зависимости от химического элемента. | Ионы могут иметь различные радиусы в зависимости от количества электронов. Катионы имеют меньший радиус, чем соответствующие им нейтральные атомы, так как они имеют меньше электронов. Анионы имеют больший радиус, так как они имеют больше электронов. |
| Степень структуры | Атомы образуют молекулы и соединения путем обмена, добавления или удаления электронов. | Ионы могут образовывать ионные соединения, где положительные ионы притягиваются к отрицательным ионам посредством электростатических сил. Это приводит к образованию кристаллической структуры. |
| Химические свойства | Атомы обладают своими химическими свойствами, определяющими их реакционную способность с другими атомами. | Ионы имеют измененную реакционную способность в сравнении с нейтральными атомами из-за измения их заряда. Это позволяет ионам образовывать стабильные соединения с другими ионами и атомами. |
Таким образом, строение ионов и атомов различается в электрическом заряде, размере ионов, степени структуры и химических свойствах, что определяют их роль в химических реакциях и взаимодействии с другими веществами.
Что такое ионная и металлическая связь в химии
До появления знания об электроне, в науке главенствовала теория о валентности как о скрепляющей атомы внутри вещества силе.
В начале прошлого века, когда появилась модель атомного ядра и выяснилось, что оно состоит из частиц трех видов: электронов, протонов и нейтронов — теория о валентности сменилась теорией о химических связях.
Феномен химических связей объясняется стремлением всего к упорядочиванию. Частицы веществ стремятся к наиболее стабильным и устойчивым формам с минимальным расходом энергии, благодаря чему появляется множество соединений.
Современная химия различает до шести видов связей, но чаще всего рассматривает только первые четыре из них:
- металлическая;
- ковалентная;
- ионная;
- водородная;
- ван-дер-ваальсова;
- двухэлектронная трехцентровая химическая.
От типа химической связи зависят ее свойства, а также строение химических решеток, структура и способы взаимодействия атомов и частиц.
Самой распространенной химической связью является ковалентная полярная, а остальные чаще всего являются либо крайними ее формами, либо вариациями с металлическими и нехарактерными неметаллическими химическими элементами в соединениях.
Ионная химическая связь
Ионная связь получила свое название от «иона» — частицы, вступающей в связь в соединении.
Ионная связь является крайней формой ковалентной полярной связи. При образовании, происходит поляризация атомов, в следствии чего образуются ионы.
Ионы могут иметь разный заряд и классифицируются по значению заряда на:
Частицы, вступающие в ионную связь, должны иметь большую разницу в 2 определение — электроотрицательности — способности притягивать электронные пары к себе. По Полингу для образования ионной связи необходима разница в 1,7 и более.
При таком виде химической связи происходит почти полный переход одного электрона к другому атому. Частицы с меньшей ЭО практически полностью переходят во владения частицы с большей ЭО, однако полного перехода никогда не случается.
Отчуждение электронов называется окислением, а присоединение — восстановлением.
Ионная связь характерна для соединений металлов и неметаллов, реже для соединений неметаллов с неметаллами, присутствует в оксидах, гидроксидах, гидридах щелочных и щелочноземельных металлов, в солях, соединениях металлов с галогенами.
Ионная связь характеризуется двумя главными чертами:
- ненаправленностью;
- ненасыщаемостью.
Вещества с ионной химической связью имеют ряд особенностей:
- низкая летучесть;
- высокая температура плавления;
- низкая электростатическая проводимость из-за специфического строения кристаллической решетки;
- твердость, но при этом хрупкость веществ;
- заметная растворимость соединений в полярных растворителях.
Металлическая связь
Атомы металлов имеют возможность соединяться не только с неметаллами, но и между собой. В таком случае происходит формирование металлической связи.
В металлическую связь вступают частицы двух видов:
- ионизированных атомов металлов, которые в процессе формирования отдают электроны, а значит получают положительный заряд;
- свободных электронов, называемых «электронным газом», имеющих отрицательный заряд по своей природе происхождения.
Металлическая связь образуется только в веществах, а не между отдельными атомами. При этом связи внутри вещества связи не перманенты и не отличаются постоянством.
Кристаллическая решетка в веществах с металлической связью образуется в виде некого каркаса, в узлах которого находятся ионы металлов, а между ними в свободной форме путешествует «электронный газ», состоящий из свободных электронов.
Форма кристаллической решетки отличается в зависимости от группы, к которой относится металл:
- щелочные металлы (литий Li, калий K, рубидий Rb и другие) имеют объемно-центрированную кубическую кристаллическую решетку;
- переходные элементы (алюминий Al, медь Cu, цинк Zn и другие) имеют гранецентрированную кубическую форму решетки;
- щелоноземельные металлы (бериллий Be, кальций Ca, радий Ra, кроме бария) имеют гексагональную решетку;
- индий In имеет тетрагональную решетку;
- ртуть Hg имеет ромбоэдричсекую решетку.
Соединения, обладающие металлической связью, представляют собой либо чистые соединения металлов, либо их сплавы, которые образуют новые вещества, например, бронзу, сталь, чугун, латунь и другие.
Все металлы и их сплавы имеют сходные физические свойства:
- металлический блеск;
- теплопроводность материала;
- высокая ковкость, пластичность материала;
- хорошая электропроводность;
- твердое агрегатное состояние в нормальных условиях среды;
- высокая плотность материала.