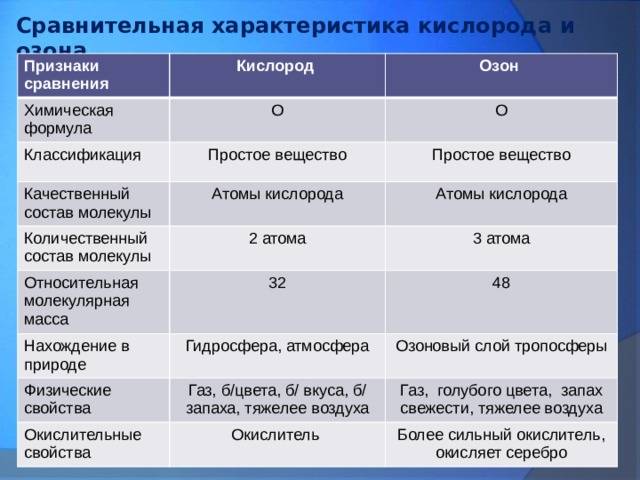
Химические свойства
Образование озона проходит по обратимой реакции:
Молекула О3 неустойчива и при достаточных концентрациях в воздухе при нормальных условиях самопроизвольно за несколько десятков минут превращается в O2 с выделением тепла. Повышение температуры и понижение давления увеличивают скорость перехода в двухатомное состояние. При больших концентрациях переход может носить взрывной характер. Контакт озона даже с малыми количествами органических веществ, некоторых металлов или их окислов резко ускоряет превращение.
В присутствии небольших количеств азотной кислоты озон стабилизируется, а в герметичных сосудах из стекла, некоторых пластмасс или чистых металлов озон при низких температурах (−78 °С) практически не разлагается.
Озон — мощный окислитель, намного более реакционноспособный, чем двухатомный кислород. Окисляет почти все металлы (за исключением золота, платины и иридия) до их высших степеней окисления. Окисляет многие неметаллы. Продуктом реакции в основном является кислород.
Озон повышает степень окисления оксидов:
Эта реакция сопровождается хемилюминесценцией. Диоксид азота может быть окислен до азотного ангидрида:
Озон не реагирует с молекулярным азотом при комнатной температуре, но при 295°С вступает с ним в реакцию:
Озон реагирует с углеродом при нормальной температуре с образованием диоксида углерода:
Озон не реагирует с аммониевыми солями, но реагирует с аммиаком с образованием нитрата аммония:
Озон реагирует с водородом с образованием воды и кислорода:
Озон реагирует с сульфидами с образованием сульфатов:
С помощью озона можно получить серную кислоту как из элементарной серы, так и из диоксида серы и сероводорода:
В газовой фазе озон взаимодействует с сероводородом с образованием диоксида серы:
В водном растворе проходят две конкурирующие реакции с сероводородом, одна с образованием элементарной серы, другая с образованием серной кислоты:
Все три атома кислорода в озоне могут реагировать по отдельности в реакции хлорида олова с соляной кислотой и озоном:
Обработкой озоном раствора иода в холодной безводной хлорной кислоте может быть получен перхлорат иода(III):
Твёрдый перхлорат нитрония русск. может быть получен реакцией газообразных NO2, ClO2 и O3:
Озон может участвовать в реакциях горения, при этом температуры горения выше, чем с двухатомным кислородом:
Озон может вступать в химические реакции и при низких температурах. При 77 K (−196 °C, температура кипения жидкого азота), атомарный водород взаимодействует с озоном с образованием гидропероксидного радикала с димеризацией последнего:
Озон может образовывать неорганические озониды, содержащие анион O3−. Эти соединения взрывоопасны и могут храниться только при низких температурах. Известны озониды всех щелочных металлов (кроме франция). KO3, RbO3 и CsO3 могут быть получены из соответствующих супероксидов:
Озонид калия может быть получен и другим путём из гидроксида калия:
NaO3 и LiO3 могут быть получены действием CsO3 в жидком аммиаке NH3 на ионообменные смолы, содержащие ионы Na+ или Li+:
Обработка озоном раствора кальция в аммиаке приводит к образованию озонида аммония, а не кальция:
Озон может быть использован для удаления железа и марганца из воды с образованием осадка (соответственно гидроксида железа(III) и диоксигидрата марганца), который может быть отделён фильтрованием:
В кислых средах окисление марганца может идти до перманганата.
Озон превращает токсичные цианиды в менее опасные цианаты:
Озон может полностью разлагать мочевину :
Взаимодействие озона с органическими соединениями с активированным или третичным атомом углерода при низких температурах приводит к соответствующим гидротриоксидам. Реакция озона с непредельными соединениями с образованием органических озонидов находит применение в анализе органических веществ.
Вещество в атмосфере
В атмосфере Земли озон находится в объёме 4 млрд тонн. Его концентрация растёт с удалением от поверхности планеты. Максимальное количество газа находится в стратосфере. Озоновый слой наблюдается на высоте 20−25 км от Земли. Хотя озона в атмосфере не так много, его хватает для обеспечения жизни на планете. Газ создаёт особый защитный слой, который не даёт опасным ультрафиолетовым лучам достичь поверхности Земли.
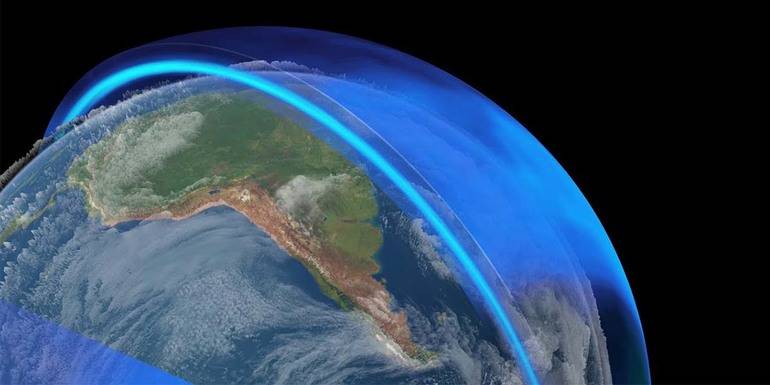
В последние годы специалисты уделяют много внимания появлению «озоновых дыр». В этих областях наблюдается значительно уменьшенный объём стратосферного вещества. Через такой тонкий газовый слой до Земли доходит жёсткое ультрафиолетовое излучение. Озон могут разрушать пыль, газы и различные естественные факторы.
Кроме того, существуют искусственные причины, воздействующие на озоновый слой. Например, фирмы создают фреоны с атомами хлора, которые используются в холодильной технике и для заполнения аэрозольных баллончиков. Эти соединения попадают в воздух, а затем постепенно поднимаются и достигают озонового слоя. Под воздействием солнечной радиации фреоны разлагаются и разрушают его.
Применение[править | править код]
Применение озона обусловлено его специфическими химическими свойствами – способностью к окислению, дезинфекции и бактерицидным свойствам, а также возможностью резкого ускорения реакций горения и достижения в них очень высоких температур.
- Наиболее широкое применение озон находит для очистки и обеззараживания питьевой и сточной воды. Озонированная вода обладает замечательными гигиеническими свойствами и отличными вкусовыми качествами. Однако сопоставимых количественных данных относительно безопасности хлора и озона пока нет.
- Использование озона для очистки сточных вод обусловленно тем что при обработке сточных вод озоном они полностью обеззараживаются.
- В пищевой промышленности озон применяется как бактерицидное средство на холодильниках продуктов, консервных и пивоваренных заводах, и в др. случаях. В качестве окислителя озон используется для отбеливания бумаги, соломы, льна, масел, и др. сырья, а также широко применяется в производстве ванилина, камфоры, жирных кислот и др. продуктов.
- В небольших количествах озон применяется для дезодорации воздуха в помещениях (туалеты, транспорт, и др).
- Возможность получения высоких температур и высокого удельного импульса ракетных топлив содержащих озон в качестве окислителя обусловило значительный практический интерес применения озона в ракетно-космической технике.
- Люстра Чижевского и другие ионизаторы воздуха являются источниками так называемых “активных форм кислорода”, среди которых озон является одним из наиболее важных.
Влияние на здоровье человека

Некоторые считают, что озон, как и кислород, полезен для организма. Многие люди любят гулять после дождя, когда в воздухе остаётся этот газ из-за грозы. Озон действительно разрушает токсические соединения и очищает кислород от вредных примесей. Из-за этого воздух после дождя свежий и приятный, а небо приобретает привлекательный лазурный оттенок.
Наличие в воздухе озона позволяет легче дышать, но сильный окислитель способен вызвать отравление и привести к летальному исходу. Негативные последствия происходят при превышении определённого порога концентрации и времени вдыхания этого вещества. Газ может вызывать мигрень, головокружения, раздражение слизистых органов зрения и обоняния, снижение артериального давления. Чрезмерное вдыхание вещества нередко способствует тому, что организм перестаёт сопротивляться бактериальным инфекциям дыхательной системы.
Учёные считают, что предельно допустимая концентрация (пдк) озона в воздухе составляет 0,1 мкг/л. Если человек проведёт несколько часов в помещении, где в воздухе будет содержаться больше 0,4 мкг/л вещества, у него появятся болезненные ощущения в груди, кашель и бессонница. Кроме того, возможно снижение остроты зрения. Более тяжёлые последствия наблюдаются при концентрации озона в воздухе свыше 2 мкг/л.
Химические свойства
Кислород является необходимым для дыхания процессом, позволяющим организмам получать энергию. Он находится в атмосфере и образует около 21% ее состава. Концентрация кислорода в атмосфере остается стабильной благодаря постоянному обмену газами между организмами и окружающей средой.
Озон также присутствует в атмосфере, но его концентрация намного ниже, поскольку он образуется в результате фотохимической реакции между кислородом и ультрафиолетовым излучением. Этот процесс происходит на высоте около 20-30 километров от земной поверхности.
Однако, в некоторых случаях, таких как промышленные выбросы или автомобильные выбросы, концентрация озона может возрастать, особенно в городах. Это может привести к образованию фотохимического смога, который негативно влияет на здоровье людей и окружающую среду.
Озон имеет свойства защищать Землю от вредного ультрафиолетового излучения, блокируя его проход в атмосферу. Однако при нарушении равновесия, например, из-за разрушения озонового слоя, увеличивается проникновение ультрафиолетовых лучей, что может вызывать различные заболевания у людей и повреждение экосистемы.
Таким образом, химические свойства кислорода и озона различаются, их концентрация в атмосфере регулируется разными процессами, а их влияние на окружающую среду и здоровье человека может быть как положительным, так и отрицательным.
Степень окисления
Кислород (O2) — это атмосферный газ, который составляет около 21% общего объема атмосферы. Он является жизненно важным для всех организмов, поскольку используется в процессе дыхания для получения энергии. Кислород имеет молекулярную структуру и обладает нулевой степенью окисления.
Озон (O3) — это также форма кислорода, но с отличной структурой и степенью окисления. Озон состоит из трех атомов кислорода и обеспечивает защиту окружающей среды от вредных ультрафиолетовых лучей солнца.
Разница в степени окисления между кислородом и озоном обусловлена различными способами их образования. Кислород образуется в атмосфере как результат процессов фотосинтеза и фотодиссоциации. Озон, напротив, формируется в реакции между кислородом и ультрафиолетовым излучением в стратосфере.
Концентрация кислорода и озона в атмосфере также различается. Кислород преобладает в нижних слоях атмосферы, в то время как озон обычно находится в стратосфере.
Таким образом, степень окисления является одним из фундаментальных отличий между кислородом и озоном. Они имеют разную структуру, различные способы образования и разное распределение в атмосфере.
Реактивность и активность
Озон образуется в атмосфере благодаря фотохимической реакции между кислородом и ультрафиолетовым излучением от Солнца. Этот процесс называется озоновым образованием. Высокая концентрация озона приводит к образованию фотохимического смога, который может быть опасным для дыхания и окружающей среды.
Кислород в атмосфере более стабилен и менее реактивен по сравнению с озоном. Он является необходимым для дыхания живых организмов и играет важную роль в окружающей среде. Концентрация кислорода в атмосфере обычно составляет около 21 процента.
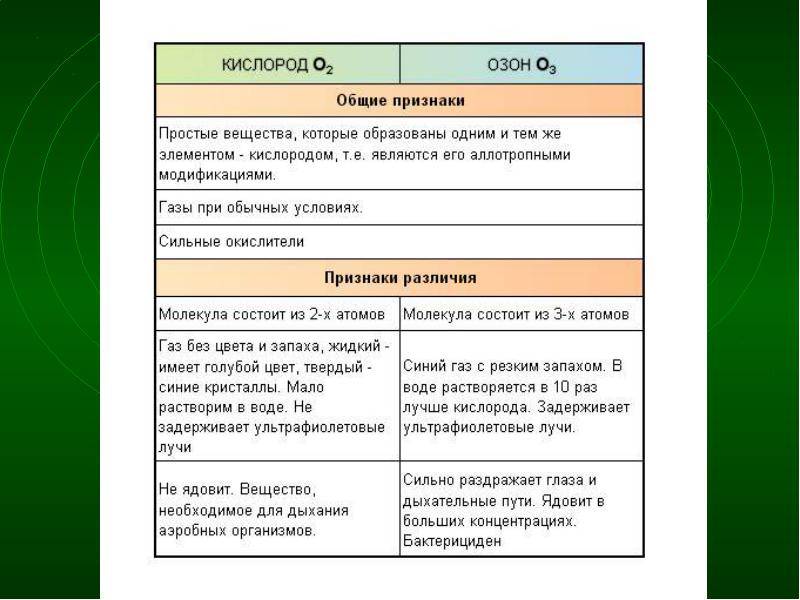
Окислительные свойства
Окислительные свойства озона означают, что он может реагировать с различными веществами и соединениями. Озон активно взаимодействует с органическими и неорганическими веществами, разрушая их структуру и меняя их химические свойства.
Одним из наиболее известных последствий окислительных свойств озона является его роль в формировании фотохимического смога. Этот тип смога образуется в результате реакции озона с загрязняющими веществами, такими как оксиды азота и углеводороды, в присутствии солнечного света.
Концентрация озона в атмосфере является важным показателем ее качества. Высокая концентрация озона может быть вредной для живых организмов, в том числе для людей, животных и растений. Она может вызывать различные респираторные проблемы, агрессивно воздействовать на легкие и приводить к развитию аллергий и других заболеваний.
Кислород (О2) также имеет окислительные свойства, но они гораздо слабее, чем у озона. Концентрация кислорода в атмосфере не является проблемой для здоровья людей и других организмов, так как он является основным компонентом воздуха, необходимым для дыхания.
Пути образования озона в атмосфере связаны с рядом химических реакций, включая фотохимическую реакцию между кислородом и ультрафиолетовым излучением. Этот процесс особенно активен в присутствии загрязняющих веществ, особенно оксидов азота.
История открытия

Озон был открыт в 1785 году. Нидерландский физик Мартин Ван Марум обнаружил вещество во время проводимых им опытов. Учёный пропустил через воздух электрический ток, после чего возник незнакомый запах. В результате реакции получился неизвестный газ синеватого цвета. По окислительным свойствам вещество оказалось сильнее кислорода. Кроме того, неизвестный газ воздействовал на ртуть при нормальных условиях и заставлял её терять характерный блеск и прилипать к стеклу.
Ван Марум полагал, что это была некая электрическая материя. Но он не считал его открытие важным. Только через половину столетия этим газом снова заинтересовались учёные.
Немец Кристиан Фридрих Шенбейн тщательно изучил нераскрытую материю и её свойства. В 1840 году он дал веществу название «озон», что на греческом означает «пахнуть». Такое наименование было связано со специфическим запахом газа. По ошибке многие считают, что именно Шенбейн был первооткрывателем этой материи. Учёный провёл эксперимент, в ходе которого озон вытеснял иод из иодида калия. Эта качественная реакция позволяет определить наличие вещества при помощи иодкрахмальной бумаги, которая приобретает синий оттенок.
В 1880 году французские учёные Готфейль и Шаппюи смогли получить вещество из кислорода при температуре -23oC. Когда газ медленно сжимался, он постепенно приобретал тёмно-синий оттенок. Затем давление резко сбросили, а температура ещё понизилась, что привело к образованию фиолетовых капель жидкого озона. Если вещество не охлаждали или быстро сжимали, тогда оно переходило в кислород с мгновенной жёлтой вспышкой.
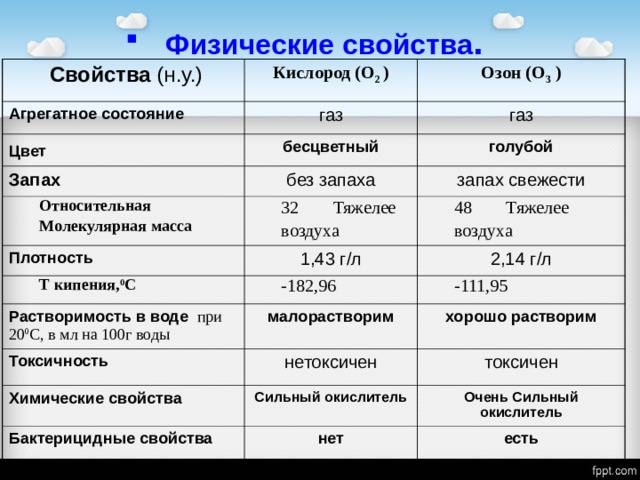
Физические свойства
Одно из главных различий между кислородом и озоном заключается в их концентрации в окружающей среде. Кислород является основной составляющей атмосферы и составляет около 21% объема воздуха. Озон, с другой стороны, присутствует в атмосфере в значительно меньших количествах и его концентрация составляет всего лишь несколько частей на миллион (ppm).
Атмосферный озон образуется в результате фотохимических реакций, которые происходят под воздействием ультрафиолетового излучения от Солнца. В то время как кислород является двухатомной молекулой, озон представляет собой триатомную молекулу, состоящую из трех атомов кислорода.
Высокая реакционная активность озона — одна из особых характеристик этого соединения. Озон обладает способностью реагировать с различными веществами в атмосфере и создавать фотохимический смог. Кислород, с другой стороны, менее активен химически и в основном служит для обеспечения дыхания организмов.
Плотность и агрегатное состояние
Кислород является главным компонентом атмосферы и составляет около 21% ее объема. Он существует в виде двухатомной молекулы (O2), где два атома кислорода соединены с помощью ковалентных связей. Плотность кислорода при нормальных условиях составляет около 1,4 г/л.
Озон, с другой стороны, представляет собой альтернативную форму кислорода и имеет форму трехатомной молекулы (O3). Озон образуется в атмосфере благодаря фотохимическим реакциям, в основном при участии ультрафиолетового излучения от Солнца. Он имеет гораздо более низкую концентрацию в атмосфере по сравнению с кислородом и составляет всего около 0,00006% от общего объема. Плотность озона составляет около 2,144 г/л.
Оба газа, кислород и озон, играют важную роль в окружающей среде и атмосфере. Концентрация озона, его пути образования и распределение являются ключевыми аспектами понимания фотохимического смога и его влияния на здоровье человека и экосистемы.
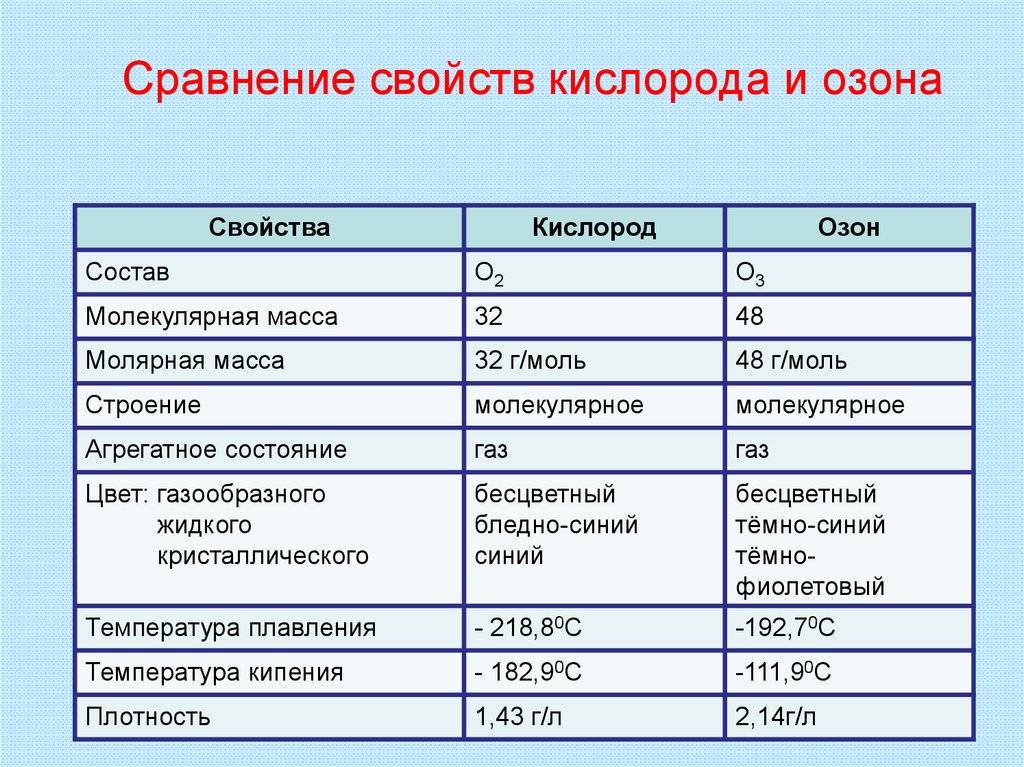
| Свойство | Кислород | Озон |
|---|---|---|
| Агрегатное состояние | Газ | Газ |
| Плотность (при нормальных условиях) | 1,4 г/л | 2,144 г/л |
| Концентрация в атмосфере | 21% | 0,00006% |
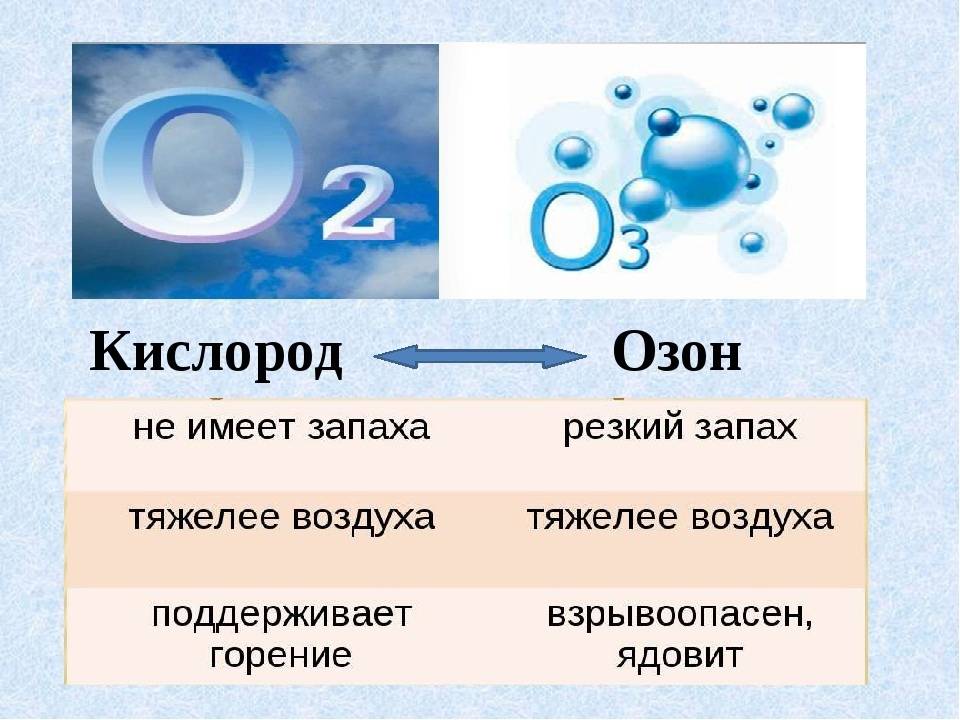
Цвет и запах
Одно из основных отличий между кислородом и озоном заключается в их цвете и запахе.
Кислород, который является двухатомной молекулой, сам по себе безцветный и без запаха. Он обычно существует в свободной форме в атмосфере и является важным компонентом для дыхания живых организмов. Кислород образуется в окружающей среде в результате фотосинтеза и других процессов, и его концентрация может варьировать в зависимости от условий окружающей среды.
Озон, с другой стороны, имеет характерный бледно-голубой цвет и специфический запах. Он представляет собой трехатомную молекулу кислорода и образуется в результате фотохимических реакций с участием солнечного излучения. Повышение концентрации озона в атмосфере может привести к образованию фотохимического смога, который может оказывать вредное влияние на окружающую среду и здоровье человека.
Таким образом, цвет и запах являются важными характеристиками кислорода и озона, которые помогают отличить их друг от друга и понять их роль в окружающей среде.
Точка кипения и температура плавления
Кислород имеет точку кипения при -183 °C и температуру плавления при -218 °C. Это означает, что при обычных условиях атмосферы и окружающей среды, кислород находится в жидком или газообразном состоянии. Возможность существования кислорода в виде жидкости делает его ценным ресурсом для использования в многих областях, например, в медицине или промышленности.
Озон, в свою очередь, имеет точку кипения при -111.9 °C и температуру плавления при -192.6 °C. Из-за таких низких температур озон находится в газообразном состоянии при обычных условиях окружающей среды. Озон играет важную роль в атмосфере Земли, участвуя в фотохимических процессах и оказывая влияние на окружающую среду. Его концентрация и распределение в атмосфере важны для поддержания здоровья планеты и людей, так как озон защищает от ультрафиолетового излучения.
Физические особенности
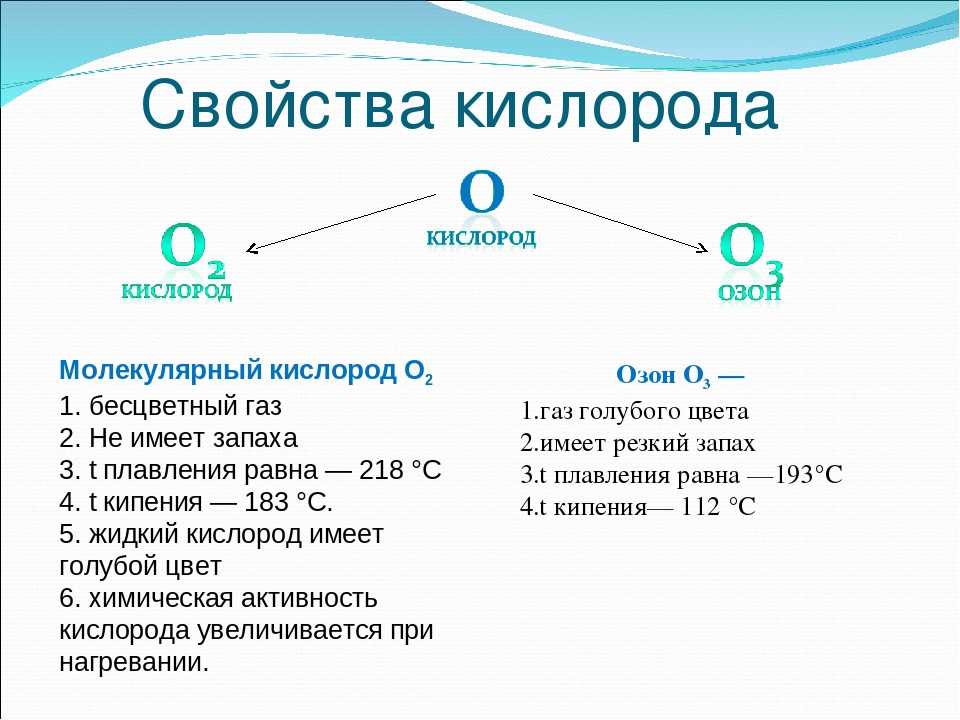
Вещество представляет аллотропную модификацию кислорода, состоящую из трёхатомных молекул. Химическая формула озона и обозначение — O3. При нормальных условиях вещество выглядит как голубой ядовитый газ с резким запахом, напоминающим металлический аромат. При сжижении преобразуется в жидкость оттенка индиго. В твёрдом состоянии выглядит как тёмно-синие или чёрные кристаллы. Полярная молекула отличается уголковым строением. Между атомами имеется две связи О-О.
Основные физические свойства озона:
- молярная масса — 48 а. е. м.;
- температура кипения — 111,8oC;
- температура плавления — 197,2oC;
- растворимость в воде при 0о — 0,394 кг/м3.
O3 растворяется в воде в 10 раз быстрее, чем кислород. А с наличием примесей реакция ускоряется в несколько раз. В виде газа озон выступает диамагнетиком, а в жидком состоянии — слабым парамагнетиком. Производная кислорода отлично растворяется во фреонах с образованием стабильных растворов, которые возможно перевозить. Жидкий озон можно смешивать с азотом, аргоном, метаном, фтором, углекислотой и тетрахлоруглеродом в том же агрегатном состоянии.
Совместное влияние кислорода и озона: экосистема и климат
Кислород и озон играют важную роль в экосистеме и климате Земли. Оба газа имеют свои характеристики и свойства, которые влияют на различные процессы и жизнь на планете.
Одним из основных источников кислорода в атмосфере являются фотосинтезирующие организмы, такие как растения и водоросли. Они поглощают углекислый газ и выделяют кислород в ходе процесса фотосинтеза. Этот кислород необходим для дыхания многих живых организмов, включая человека. Отсутствие кислорода может привести к ухудшению состояния окружающей среды и нарушению жизненных процессов в экосистеме.
Озон, в свою очередь, играет роль фильтра ультрафиолетового (УФ) излучения. Он находится в стратосфере и предотвращает часть УФ-излучения Солнца от достижения поверхности Земли. Без озона, повышенное УФ-излучение может иметь негативные последствия для здоровья человека и экосистемы. Например, оно может вызывать повреждение ДНК, снижение урожайности растений и ухудшение состояния океанских экосистем.
Совместное влияние кислорода и озона важно для поддержания баланса в экосистеме и климате. Они взаимосвязаны и влияют на другие химические и физические процессы в атмосфере и гидросфере
Например, кислород участвует в окислительно-восстановительных реакциях, которые влияют на состав атмосферы и океана. Озон, в свою очередь, взаимодействует с другими газами, такими как азотные оксиды и углеводороды, образуя различные вещества в атмосфере.
Исследование и понимание совместного влияния кислорода и озона является важной задачей для науки и охраны окружающей среды. Только учитывая их взаимодействие, мы сможем разработать эффективные стратегии и меры для сохранения экосистемы и борьбы с климатическими изменениями
Воздействие на окружающую среду
Кислород — это простая химическая формула O₂, значения которой широко применяются в различных отраслях науки и промышленности. Именно этот элемент составляет основу воздуха, который мы дышим. Он не только необходим для дыхания, но также участвует в химических реакциях и процессах окисления.
Озон — это трехатомный молекулы кислорода, обозначаемый как O₃. В отличие от кислорода, озон является мощным окислителем и играет роль в защите жизни на Земле от вредного ультрафиолетового излучения. У него способность поглощать ионизирующую радиацию, благодаря чему создается озоновый слой в стратосфере, который защищает нас от УФ-лучей.
Поэтому, кислород и озон, хотя и оба состоят из атомов кислорода, имеют различные свойства и воздействуют на окружающую среду по-разному. Кислород необходим для дыхания и процессов окисления, а озон — защитник человечества от вредных УФ-лучей.
Кислородное дыхание
Когда мы вдыхаем, кислород поступает в наши легкие, где он связывается с красными кровяными клетками и транспортируется по всему организму через кровеносную систему. Затем кислород используется клетками для окисления питательных веществ и выработки энергии.
Озон, в свою очередь, представляет собой трехатомную форму кислорода и имеет химическую формулу — O3. Он полезен в стратосфере Земли, где образует озоновый слой, который защищает нас от вредного ультрафиолетового излучения солнца.
Использование кислорода для дыхания является неотъемлемым процессом для жизни человека и других организмов. Кислород и озон имеют разные свойства и функции, но они оба играют важную роль в нашей жизни и на планете в целом.
Озоновый слой
Главное отличие озонового слоя от атмосферного воздуха заключается в его составе. В отличие от кислорода, который состоит из двух атомов (O2), озон представляет собой трехатомную молекулу (O3). Такая химическая формула позволяет озону быть более активным и реактивным в сравнении с кислородом.
Одной из важнейших функций озонового слоя является поглощение ультрафиолетового излучения, которое в больших количествах может быть опасным для живых организмов. Озон поглощает значительную часть ультрафиолета, предотвращая его попадание на поверхность Земли.
Ущерб озоновому слою наносит разрушительное воздействие человеческой деятельности, прежде всего, промышленного производства. Хлор-фторуровые углеводороды (ФАУ), используемые в промышленности, отрицательно влияют на озоновый слой, вызывая его разрушение. Нарушение естественного баланса озонового слоя может привести к негативным последствиям, таким как повышение уровня ультрафиолета, увеличение заболеваемости кожи, глаз и респираторных органов, а также сокращение количества планктона и растений в океанах.
Поэтому защита и сохранение озонового слоя является важнейшей задачей для всего человечества. Международные договоры и соглашения стремятся снизить использование вредных веществ и регулировать выбросы отходов, способствующие разрушению озонового слоя.
Применение озона
Применение озона обусловлено его свойствами:
- сильного окисляющего реагента:
- для стерилизации изделий медицинского назначения;
- при получении многих веществ в лабораторной и промышленной практике;
- для отбеливания бумаги;
- для очистки масел.
- сильного дезинфицирующего средства:
- для очистки воды и воздуха от микроорганизмов (озонирование);
- для дезинфекции помещений и одежды;
- для озонирования растворов, применяемых в медицине (как для внутривенного, так и для контактного применения).
Существенными достоинствами озонирования, по сравнению с хлорированием, является отсутствие токсинов (кроме формальдегида) в обработанной воде (тогда как при хлорировании возможно образование существенного количества хлорорганических соединений, многие из которых токсичны, например, диоксин) и лучшая, по сравнению с кислородом, растворимость в воде.
По заявлениям озонотерапевтов, здоровье человека значительно улучшается при лечении озоном (наружно, перорально, внутривенно и экстракорпорально), однако ни одно объективное клиническое исследование не подтвердило сколько-нибудь выраженный терапевтический эффект. Более того, при использовании озона в качестве лекарственного средства (особенно при непосредственном воздействии на кровь пациента) доказанный риск канцерогенного и токсического воздействия перевешивает любые теоретически возможные положительные эффекты, поэтому практически во всех развитых странах озонотерапия не признаётся лекарственным методом, а её применение в частных клиниках возможно исключительно с информированного согласия пациента.
В XXI веке многие фирмы начали выпуск так называемых бытовых озонаторов, предназначенных также для дезинфекции помещений (подвалов, комнат после вирусных заболеваний, складов, заражённых бактериями и грибками вещей), зачастую умалчивая о мерах предосторожности, необходимых при применении данной техники
Применение жидкого озона
Давно рассматривается применение озона в качестве высокоэнергетического и вместе с тем экологически чистого окислителя в ракетной технике. Общая химическая энергия, освобождающаяся при реакции сгорания с участием озона, больше, чем для простого кислорода, примерно на одну четверть (719 ккал/кг). Больше будет, соответственно, и удельный импульс. У жидкого озона большая плотность, чем у жидкого кислорода (1,35 и 1,14 г/см3 соответственно), а его температура кипения выше (−112 °C и −183 °C соответственно), поэтому в этом отношении преимущество в качестве окислителя в ракетной технике больше у жидкого озона. Однако препятствием является химическая неустойчивость и взрывоопасность жидкого озона с разложением его на O и O2, при котором возникает движущаяся со скоростью около 2 км/с детонационная волна и развивается разрушающее детонационное давление более 3·107 дин/см2 (3 МПа), что делает применение жидкого озона невозможным при нынешнем уровне техники, за исключением использования устойчивых кислород-озоновых смесей (до 24 % озона). Преимуществом подобной смеси также является больший удельный импульс для водородных двигателей, по сравнению с озон-водородными. На сегодняшний день такие высокоэффективные двигатели, как РД-170, РД-180, РД-191, а также разгонные вакуумные двигатели вышли по УИ на близкие к предельным параметры, и для повышения удельного импульса необходимо найти возможность перейти на новые виды топлива.
Как
Молекулярный кислород – важнейшее простое вещество на Земле. Образуется в зеленых частях растений на свету в При электрических разрядах природного либо искусственного происхождения двухатомная молекула кислорода распадается. Температура, при которой начинается процесс, составляет около 2000 °С. Часть возникших радикалов соединяется вновь, образуя кислород. Некоторые активные частицы вступают в реакцию с двухатомными молекулами кислорода. В этой реакции получается озон, который также реагирует со свободными радикалами кислорода. При этом возникают двухатомные молекулы. Обратимость реакций приводит к тому, что концентрация атмосферного озона постоянно изменяется. В стратосфере образования слоя, состоящего из молекул O 3 , связано с ультрафиолетовым излучением Солнца. Без этого защитного экрана опасные лучи могли бы достигнуть поверхности Земли и уничтожить все формы жизни.