СОДЕРЖАНИЕ
- 1 Физические свойства
- 1.1 Марки серной кислоты
- 1.2 Полярность и проводимость
- 2 Химические свойства
- 2.1 Реакция с водой и обезвоживание
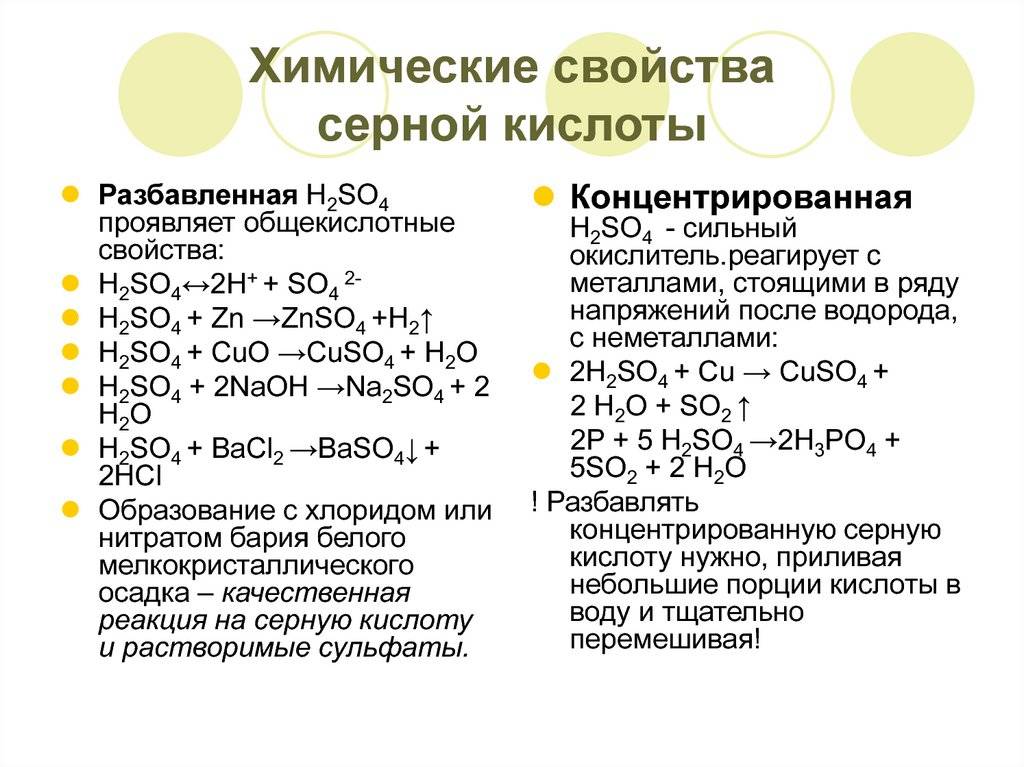
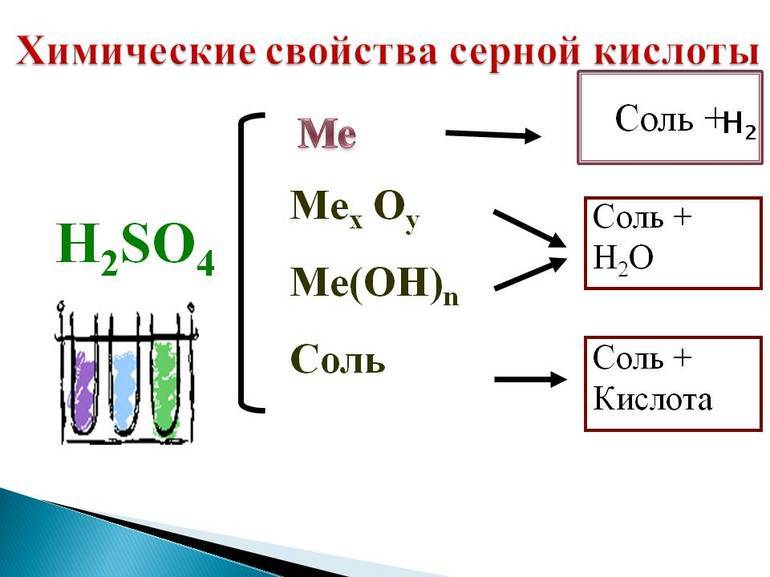
- 2.2 Кислотно-основные свойства
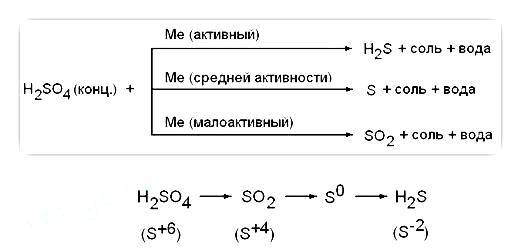
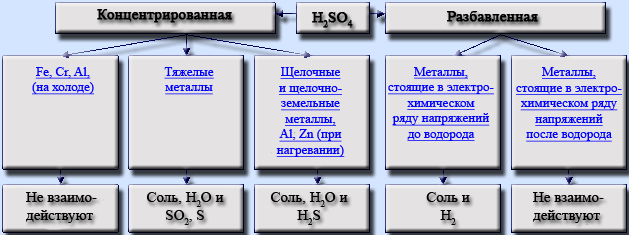
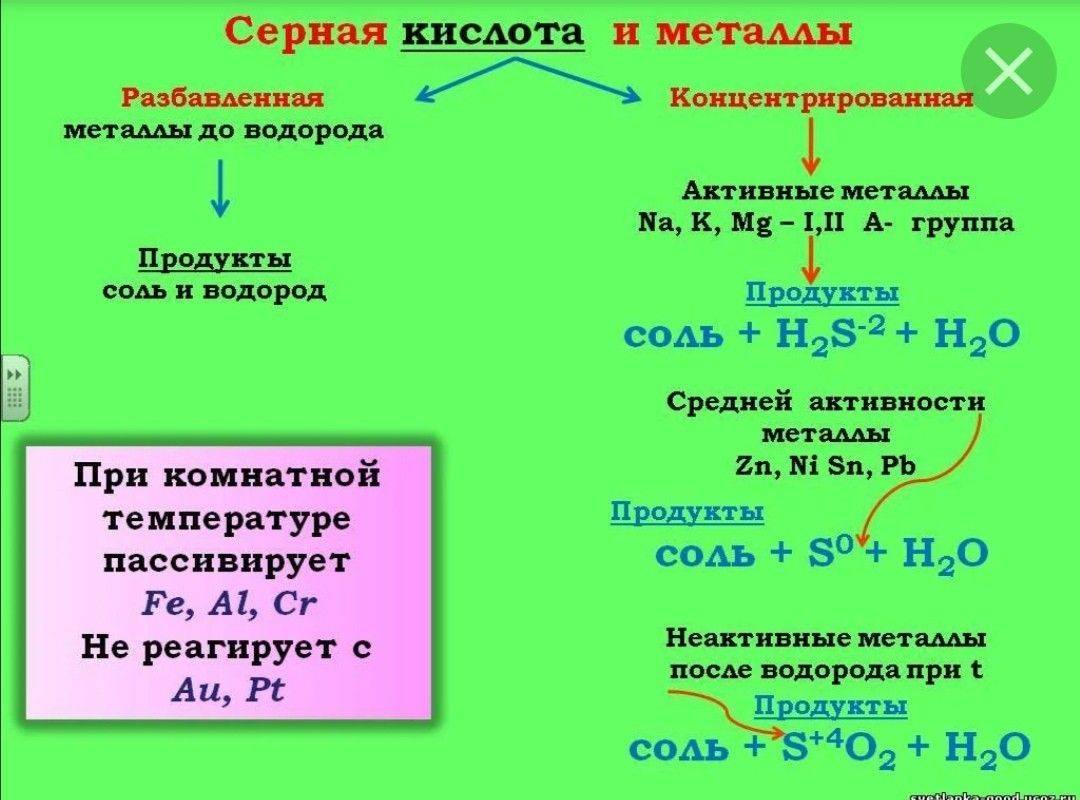
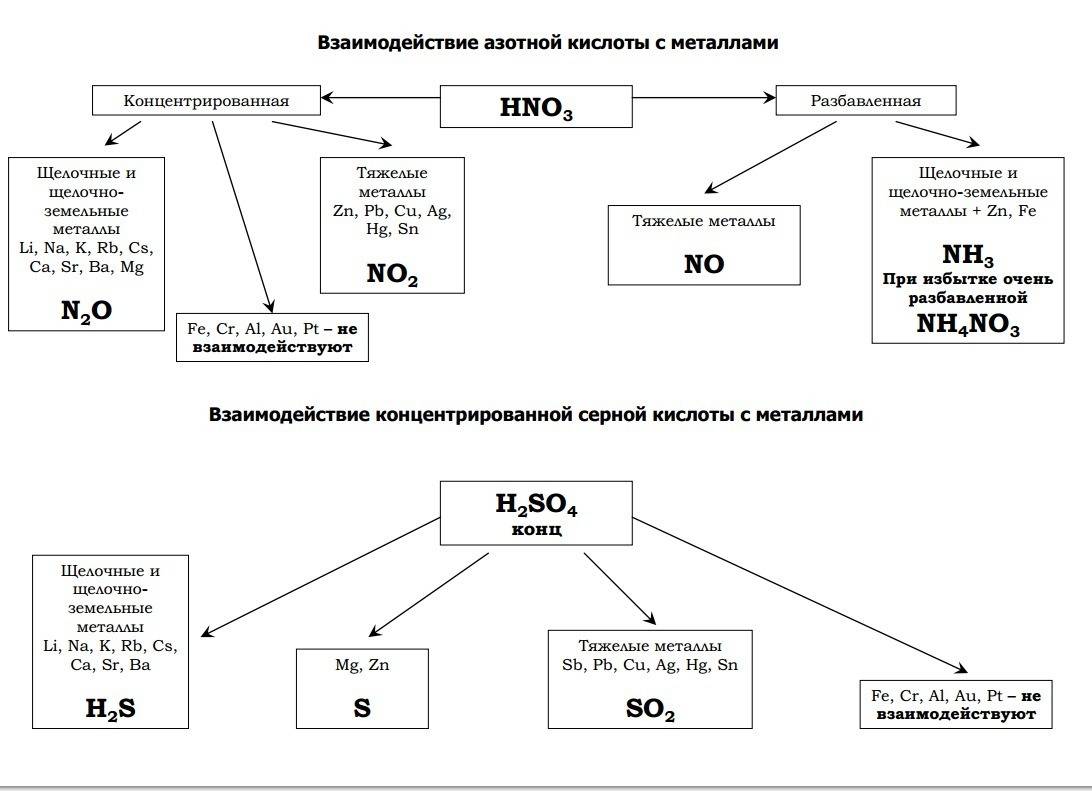
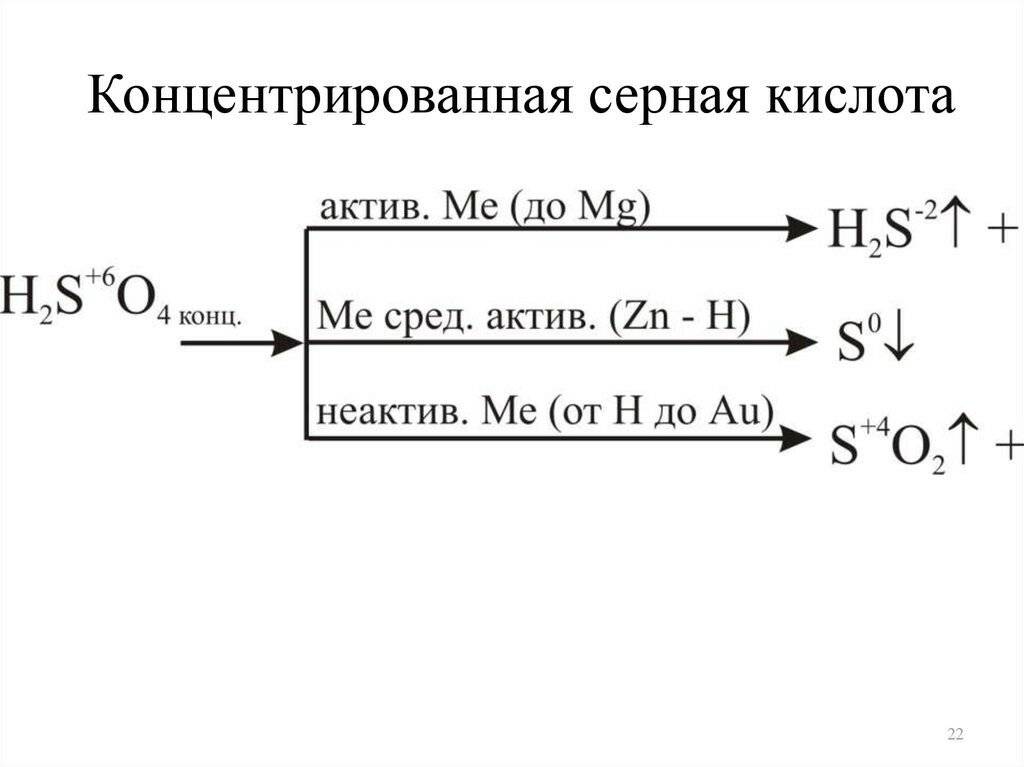
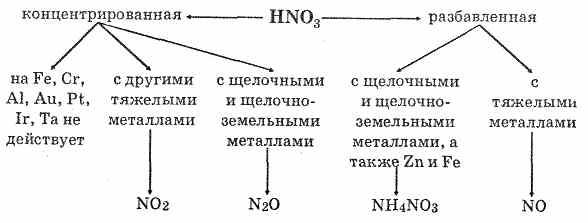
- 2.3 Реакции с металлами
- 2.4 Реакции с углеродом
- 2.5 Реакция с хлоридом натрия
- 2.6 Электрофильное ароматическое замещение
- 3 Возникновение
- 3.1 Стратосферный аэрозоль
- 3.2 Внеземная серная кислота
- 4 Производство
- 4.1 Контактный процесс
- 4.2 Обработка мокрой серной кислоты
- 4.3 Другие методы
- 5 применений
- 5.1 Промышленное производство химикатов
- 5.2 Серно-йодный цикл
- 5.3 Промышленное чистящее средство
- 5.4 Катализатор
- 5.5 Электролит
- 5.6 Бытовое использование
- 6 История
- 7 Безопасность
- 7.1 Лабораторные опасности
- 7.2 Опасность разбавления
- 7.3 Промышленные опасности
- 8 Правовые ограничения
- 9 См. Также
- 10 Ссылки
- 11 Внешние ссылки
Опасные свойства серной кислоты для человека
Серная кислота представляет повышенную опасность для человеческого организма. Ее токсическое действие наступает не только при непосредственном контакте с кожей, но при вдыхании ее паров, когда происходит выделение сернистого газа. Опасное воздействие распространяется на:
- Дыхательную систему;
- Кожные покровы;
- Слизистые оболочки.
Интоксикацию организма может усилить мышьяк, который часто входит в состав серной кислоты.
Важно! Как вы знаете, при соприкосновении кислоты с кожей происходят сильнейшие ожоги. Не меньшую опасность представляет и отравление парами серной кислоты
Безопасная доза содержания серной кислоты в воздухе равняется всего 0,3 мг на 1 квадратный метр.
Если на слизистые покровы или на кожу попадает серная кислота, появляется сильный ожог, плохо заживающий. Если по масштабу ожог внушительный, у пострадавшего развивается ожоговая болезнь, которая может привести даже к смертельному исходу, если своевременно не будет оказана квалифицированная медицинская помощь.
Важно! Для взрослого человека смертельная доза серной кислоты равняется всего 0,18 см на 1 литр.
Безусловно, «испытать на себе» токсическое действие кислоты в обычной жизни проблематично. Чаще всего отравление кислотой происходит из-за пренебрежения техникой безопасности на производстве при работе с раствором.
Может случиться массовое отравление парами серной кислоты вследствие технических неполадок на производстве или неосторожности, и происходит массивный выброс в атмосферу. Для предотвращения таких ситуаций работают специальные службы, задача которых контролировать функционирование производства, где используется опасная кислота
Какие симптомы наблюдаются при интоксикации серной кислотой
Если кислота была принята внутрь:
- Боль в области пищеварительных органов.
- Тошнота и рвота.
- Нарушение стула, как итог сильных кишечных расстройств.
- Сильное выделение слюны.
- Из-за токсического воздействия на почки, моча становится красноватой.
- Отек гортани и горла. Возникают хрипы, осиплость. Это может привести к летальному исходу от удушья.
- На деснах появляются бурые пятна.
- Кожные покровы синеют.
При ожоге кожных покровов могут быть все осложнения, присущие для ожоговой болезни.
При отравлении парами наблюдается такая картина:
- Ожог слизистой оболочки глаз.
- Носовое кровотечение.
- Ожог слизистых оболочек дыхательных путей. При этом пострадавший испытывает сильный болевой симптом.
- Отек гортани с симптомами удушения (нехватка кислорода, кожа синеет).
- Если отравление сильное, то может быть тошнота и рвота.
Важно знать! Отравление кислотой после приема внутрь намного опасней, чем интоксикация от вдыхания паров
Первая помощь и терапевтические процедуры при поражении серной кислотой
Действуйте по следующей схеме при контакте с серной кислотой:
- Первым делом вызовите скорую помощь. Если жидкость попала внутрь, то сделайте промывание желудка теплой водой. После этого мелкими глотками понадобится выпить 100 граммов подсолнечного или оливкового масла. Вдобавок, следует проглотить кусочек льда, выпить молоко или жженую магнезию. Это нужно сделать для снижения концентрации серной кислоты и облегчения состояния человека.
- Если кислота попала в глаза, нужно промыть их проточной водой, а затем закапать раствором дикаина и новокаина.
- При попадании кислоты на кожу, обожженное место нужно хорошо промыть под проточной водой и наложить повязку с содой. Промывать нужно около 10-15 минут.
- При отравлении парами нужно выйти на свежий воздух, а также промыть по мере доступности пострадавшие слизистые водой.
В условиях стационара лечение будет зависеть от площади ожога и степени отравления. Обезболивание осуществляют только новокаином. Во избежание развития в области поражения инфекции, пациенту подбирают курс антибиотикотерапии.
При желудочном кровотечении вводится плазма или переливается кровь. Источник кровотечения могут устранять оперативным путем.
Серная кислота: общая информация
Серная кислота является сильным окислителем и реагентом. В обычных условиях она обладает высокой агрессивностью и коррозионными свойствами. Она способна растворять множество органических и неорганических веществ, в том числе металлы и многие сплавы.
Серная кислота может быть разбавленной или концентрированной. Разбавленная серная кислота обычно содержит около 10-15% H2SO4. Она менее агрессивна и более безопасна для использования, но все равно обладает значительной кислотностью.
| Тип кислоты | Содержание H2SO4 | Свойства |
|---|---|---|
| Разбавленная серная кислота | 10-15% | Меньшая агрессивность |
| Концентрированная серная кислота | Подавляющее большинство | Высокая кислотность, высокая коррозионная активность |
Концентрированная серная кислота, в отличие от разбавленной, обычно содержит подавляющее большинство H2SO4 и является намного более кислотной
Использование концентрированной серной кислоты требует особой осторожности и соблюдения мер безопасности
Серная кислота имеет широкое применение в промышленности, лабораторных и хозяйственных целях. Она используется в производстве удобрений, пластиков, красителей, взрывчатых веществ, а также в качестве реагента при проведении химических реакций и анализах.
Необходимо помнить, что использование серной кислоты требует осторожности и соблюдения мер безопасности. При работе с ней необходимо использовать защитные средства, такие как резиновые перчатки, защитные очки и хорошую вентиляцию помещения
Состав и свойства
Разбавленная серная кислота, также известная как слабая серная кислота, имеет низкую концентрацию активного вещества — H2SO4. Это делает ее менее опасной и коррозивной по сравнению с концентрированной серной кислотой.
Концентрированная серная кислота имеет высокую концентрацию H2SO4, что делает ее очень опасной и агрессивной веществом. Она обладает сильными коррозионными свойствами, способна вызывать ожоги при контакте с кожей и наносить серьезные повреждения материалам.
Оба типа серной кислоты обладают важными свойствами. Они являются сильными кислотами, способными действовать на многие виды веществ. Они также играют важную роль в промышленности, используясь в процессах химической синтеза и производства многих продуктов.
Свойства разбавленной и концентрированной серной кислоты различаются в зависимости от их концентрации
Разбавленная серная кислота слабее коррозивна и менее опасна для использования, в то время как концентрированная серная кислота обладает сильными коррозионными свойствами и требует особой осторожности при обращении
Использование должно быть согласовано с инструкциями и соответствовать безопасным стандартам и протоколам.
Применение и опасность
Разбавленная серная кислота широко используется в различных сферах промышленности и научных исследований. Она применяется как реагент в химическом синтезе, в процессах очистки воды и в производстве удобрений. Кроме того, разбавленную серную кислоту можно найти в домашнем использовании для очистки и дезинфекции различной посуды и поверхностей.
Однако, несмотря на широкое применение, разбавленная серная кислота является опасным веществом. Она может вызвать серьезные ожоги при контакте с кожей, глазами и дыхательными путями. При попадании в организм она может вызвать острой отравление и негативно повлиять на здоровье человека
Поэтому при работе с разбавленной серной кислотой необходимо соблюдать меры предосторожности, включая использование защитной одежды, очков и масок
Концентрированная серная кислота является еще более опасным веществом. Она может вызвать глубокие ожоги даже при кратковременном контакте с кожей и глазами. Кроме того, при нагревании она образует ядовитые пары, которые могут привести к серьезным проблемам с дыхательной системой
В связи с этим, работа с концентрированной серной кислотой требует особой осторожности и проведения в специально оборудованных помещениях
Важно помнить, что работа с серной кислотой требует профессиональной подготовки и соблюдения всех необходимых мер безопасности. При возникновении любых неприятных симптомов, необходимо незамедлительно обратиться за медицинской помощью
Физические и физико-химические свойства[]
Серная кислота в реальной жизни
Молекулярная масса 98,082 г/моль; бесцветная маслянистая жидкость без запаха. Очень сильная двухосновная кислота, при 18℃ pKa₁ −2,8, К₂ 1,2 10², pKa₂ 1,92; длины связей в молекуле S=O 0,143 нм, S—OH 0,154 нм, угол HOSOH 104°, OSO 119°; кипит, образуя азеотропную смесь (98,3 % H₂SO₄ и 1,7 % H₂O с температурой кипения 338,8℃). Серная кислота, отвечающая 100%-ному содержанию H₂SO₄, имеет состав (%): H₂SO₄ 99,5, HSO₄- — 0,18, H₃SO₄+ — 0,14, H₃O+ — 0,09, H₂S₂O₇, — 0,04, HS₂O₇⁻ — 0,05. Смешивается с водой и SO₃, во всех соотношениях. В водных растворах серная кислота практически полностью диссоциирует на H+, HSO₄-, и SO₄²-. Образует гидраты H₂SO₄·nH₂O, где n = 1, 2, 3, 4 и 6,5.
Олеум
Растворы SO₃ в cерной кислоте называются олеумом, они образуют два соединения H₂SO₄·SO₃ и H₂SO₄·2SO₃. Олеум содержит также пиросерную кислоту, получающуюся по реакции:
- H₂SO₄ + SO₃ → H₂S₂O₇.
Температура кипения водных растворов cерной кислоты повышается с ростом ее концентрации и достигает максимума при содержании 98,3 % H₂SO₄.
| Содержание % по массе | Плотность при 20℃, г/см³ | Температура кристаллизации, ℃ | Температура кипения, ℃ | |
|---|---|---|---|---|
| H₂SO₄ | SO₃ (свободный) | |||
| 10 | – | 1,0661 | −5,5 | 102,0 |
| 20 | – | 1,1394 | −19,0 | 104,4 |
| 40 | – | 1,3028 | −65,2 | 113,9 |
| 60 | – | 1,4983 | −25,8 | 141,8 |
| 80 | – | 1,7272 | −3,0 | 210,2 |
| 98 | – | 1,8365 | 0,1 | 332,4 |
| 100 | – | 1,8305 | 10,4 | 296,2 |
| 104,5 | 20 | 1,8968 | −11,0 | 166,6 |
| 109 | 40 | 1,9611 | 33,3 | 100,6 |
| 113,5 | 60 | 2,0012 | 7,1 | 69,8 |
| 118,0 | 80 | 1,9947 | 16,9 | 55,0 |
| 122,5 | 100 | 1,9203 | 16,8 | 44,7 |
Температура кипения олеума с увеличением содержания SO₃ понижается. При увеличении концентрации водных растворов cерной кислоты общее давление пара над растворами понижается и при содержании 98,3 % H₂SO₄ достигает минимума. С увеличением концентрации SO₃, в олеуме общее давление пара над ним повышается. Давление пара над водными растворами серной кислоты и олеума можно вычислить по уравнению:
- lgp(Па) = A — B/T + 2,126,
величины коэффициентов А и В зависят от концентрации серной кислоты. Пар над водными растворами серной кислоты состоит из смеси паров воды, H₂SO₄ и SO₃, при этом состав пара отличается от состава жидкости при всех концентрациях cерной кислоты, кроме соответствующей азеотропной смеси.
С повышением температуры усиливается диссоциация H₂SO₄ H₂O + SO₃ — Q, уравнение температурной зависимости константы равновесия lnKp = 14,74965 − 6,71464ln(298/T) — 8,10161·10⁴T² — 9643,04/T — 9,4577·10⁻³T + 2,19062·10⁻⁶T². При нормальном давлении степень диссоциации: 10⁻⁵ (373 К), 2,5 (473 К), 27,1 (573 К), 69,1 (673 К). Плотность 100%-ной cерной кислоты можно определить по уравнению: d = 1,8517 − 1,1·10⁻³t + 2·10⁻⁶t² г/см³. С повышением концентрации растворов серной кислоты их теплоемкость уменьшается и достигает минимума для 100%-ной серной кислоты, теплоемкость олеума с повышением содержания SO³ увеличивается.
При повышении концентрации и понижении температуры теплопроводность λ уменьшается: λ = 0,518 + 0,0016t — (0,25 + t/1293)·С/100, где С-концентрация серной кислоты, в %. Максимальнаую вязкость имеет олеум H₂SO₄·SO₃, с повышением температуры η снижается. Электрическое сопротивление серной кислоты минимально при концентрации 30 и 92 % H2SO4 и максимально при концентрации 84 и 99,8 % H₂SO₄. Для олеума минимальное ρ при концентрации 10 % SO₃. С повышением температуры ρ серной кислоты увеличивается. Диэлектрическая проницаемость 100%-ной серной кислоты 101 (298,15 К), 122 (281,15 К); криоскопическая постоянная 6,12, эбулиоскопическая постоянная 5,33; коэффициент диффузии пара серной кислоты в воздухе изменяется в зависимости от температуры; D = 1,67·10⁻⁵T3/2 см²/с.
Что мы узнали?
Из урока 9 класса узнали о свойствах серной кислоты. Это мощный окислитель, вступающий в реакции с металлами, неметаллами, органическими соединениями, солями, основаниями, оксидами. При взаимодействии с водой выделяется тепло. Получают серную кислоту из оксида серы. Концентрированная кислота без нагревания не взаимодействует с некоторыми металлами, что позволяет перевозить кислоту в металлической таре.
Новая заимка школа педагогический состав
Как можно создать веб страницу кратко
Какие типы анимации могут быть использованы в презентациях кратко
Бизнес план детский сад выходного дня
- Кто входит в состав комиссии по урегулированию конфликта интересов в школе
Основы химии: Разница между концентрированной и разбавленной кислотой
Концентрированная кислота содержит как можно больше активных молекул кислоты, что делает ее очень сильной. Она имеет высокую концентрацию кислотных ионов и может вызвать серьезные ожоги или коррозию веществ, с которыми она взаимодействует
Это означает, что необходимы специальные меры предосторожности при работе с концентрированными кислотами
Разбавленная кислота, как следует из ее названия, имеет более низкую концентрацию кислотных ионов. Она получается путем добавления воды к концентрированной кислоте. В результате, разбавленная кислота менее опасна для обращения и более безопасна при использовании. Она может использоваться в таких областях, как научные исследования или образование, где не требуется очень сильная кислота.
Разница между разбавленной и концентрированной кислотой заключается в их концентрации и силе. Концентрированная кислота имеет более высокую концентрацию кислотных ионов и может вызывать серьезные вредные последствия при неправильном обращении. Разбавленная кислота содержит меньшее количество кислотных ионов и используется в местах, где требуется менее сильная реакция
При работе с кислотами всегда следует соблюдать меры предосторожности и использовать соответствующие защитные средства
Химические реакции
Реакции характеризуются изменением химических связей между атомами и молекулами веществ, что приводит к образованию новых веществ с новыми свойствами. В процессе реакции могут быть выделены или поглощены энергия, измениться цвет, запах или состояние вещества.
Химические реакции могут протекать с различной скоростью. Некоторые реакции происходят очень быстро и могут сопровождаться взрывом или выделением тепла. Другие реакции могут протекать очень медленно и требовать особенных условий для их проведения.
В химии существует большое количество различных типов реакций, таких как окислительно-восстановительные, кислотно-основные, обменные и термические. Каждый тип реакции имеет свои особенности и характерные признаки в зависимости от типа веществ, участвующих в реакции.
Химические реакции широко применяются в промышленности и научных исследованиях. Они являются основой для создания новых веществ и материалов, а также для получения энергии.
| Тип реакции | Описание |
|---|---|
| Окислительно-восстановительная | Включает в себя передачу электронов от одного вещества к другому. |
| Кислотно-основная | Протекает между кислотой и основанием, сопровождается образованием солей и воды. |
| Обменная | Происходит обмен ионами или группами атомов между веществами. |
| Термическая | Сопровождается изменением температуры и протекает в результате передачи тепла. |
Дополнительные сведения
Мельчайшие капельки серной кислоты могут образовываться в средних и верхних слоях атмосферы в результате реакции водяного пара и вулканического пепла, содержащего большие количества серы. Получившаяся взвесь, из-за высокого альбедо облаков серной кислоты, затрудняет доступ солнечных лучей к поверхности планеты. Поэтому (а также в результате большого количества мельчайших частиц вулканического пепла в верхних слоях атмосферы, также затрудняющих доступ солнечному свету к планете) после особо сильных вулканических извержений могут произойти значительные изменения климата. Например, в результате извержения вулкана Ксудач (Полуостров Камчатка, 1907 г.) повышенная концентрация пыли в атмосфере держалась около 2 лет, а характерные серебристые облака серной кислоты наблюдались даже в Париже. Взрыв вулкана Пинатубо в 1991 году, отправивший в атмосферу 3⋅107 тонн серы, привёл к тому, что 1992 и 1993 года были значительно холоднее, чем 1991 и 1994.
Токсическое действие
Серная кислота и олеум — очень едкие вещества. Они поражают кожу, слизистые оболочки, дыхательные пути (вызывают химические ожоги). При вдыхании паров этих веществ они вызывают затруднение дыхания, кашель, нередко — ларингит, трахеит, бронхит и т. д. Предельно допустимая концентрация аэрозоля серной кислоты в воздухе рабочей зоны 1,0 мг/м³, в атмосферном воздухе 0,3 мг/м³ (максимальная разовая) и 0,1 мг/м³ (среднесуточная). Поражающая концентрация паров серной кислоты 0,008 мг/л (экспозиция 60 мин), смертельная 0,18 мг/л (60 мин). Класс опасности II. Аэрозоль серной кислоты может образовываться в атмосфере в результате выбросов химических и металлургических производств, содержащих оксиды S, и выпадать в виде кислотных дождей.
Производство
Контакт процесспроцесс Wet серной кислотысвинец процесс камеры
Серная кислота производится из серы, кислорода и воды с помощью обычного контактного процесса (DCDA) или процесса влажной серной кислоты (WSA).
Контактный процесс
Процесс контакта
На первом этапе сера сжигается для получения диоксида серы.
- S (s) + O2 → ТАК2
Диоксид серы окисляется кислородом до триоксида серы в присутствии катализатора на основе оксида ванадия (V). Эта реакция обратима, и образование триоксида серы является экзотермическим.
- 2 ТАК2+ O2 ⇌ 2 SO3
Трехокись серы абсорбируется 97–98% H2ТАК4с образованием олеума ( H2S2О7), также известная как дымящая серная кислота. Затем олеум разбавляют водой с образованием концентрированной серной кислоты.
- ЧАС2ТАК4 + ТАК3→ H2S2О7
- ЧАС2S2О7 + H2O → 2 H2ТАК4
Прямое растворение SO3 в воде не практикуется.
Процесс мокрой серной кислоты
мокрый процесс серной кислоты
На первом этапе сера сжигается для получения диоксида серы:
- S + O2→ ТАК2 (-297 кДж / моль)
или, альтернативно, сероводород ( H2S) газ сжигается до SO2 газ:
- 2 ч2S + 3 O2→ 2 H2O + 2 SO2 (-1036 кДж / моль)
Затем диоксид серы окисляют до триоксида серы с использованием кислорода с оксидом ванадия (V) в качестве катализатора.
- 2 ТАК2+ O2⇌ 2 SO3 (−198 кДж / моль) (реакция обратима)
Триоксид серы гидратируется до серной кислоты H2ТАК4:
- ТАК3+ H2O → H2ТАК4(г) (-101 кДж / моль)
Последним этапом является конденсация серной кислоты до жидкости 97–98% H.2ТАК4:
- ЧАС2ТАК4(г) → H2ТАК4(л) (-69 кДж / моль)
Другие методы
Менее известен метод метабисульфита, при котором метабисульфит помещается на дно химического стакана и добавляется соляная кислота с молярной концентрацией 12,6. Образующийся газ барботируют через азотную кислоту, которая по мере протекания реакции выделяет коричневые / красные пары диоксида азота. О завершении реакции свидетельствует прекращение испарения. Этот метод не дает неразрывного тумана, что довольно удобно.
- 3 SO 2 + 2 HNO 3 + 2 H 2 O → 3 H 2 SO 4 + 2 NO
Сжигание серы вместе с селитрой ( нитрат калия, KNO3) в присутствии пара использовался исторически. При разложении селитры окисляет серу до SO.3, который соединяется с водой с образованием серной кислоты.
В качестве альтернативы растворение диоксида серы в водном растворе соли окисляющего металла, такой как хлорид меди (II) или железа (III):
- 2 FeCl 3 + 2 H 2 O + SO 2 → 2 FeCl 2 + H 2 SO 4 + 2 HCl
- 2 CuCl 2 + 2 H 2 O + SO 2 → 2 CuCl + H 2 SO 4 + 2 HCl
Два менее известных лабораторных метода производства серной кислоты, хотя и в разбавленной форме и требующие дополнительных усилий при очистке. Раствор сульфата меди (II) может быть подвергнут электролизу с медным катодом и платиновым / графитовым анодом для получения губчатой меди на катоде и выделения газообразного кислорода на аноде, раствор разбавленной серной кислоты указывает на завершение реакции, когда он выходит из от синего до прозрачного (еще один признак – образование водорода на катоде):
- 2 CuSO 4 + 2 H 2 O → 2 Cu + 2 H 2 SO 4 + O 2
Более дорогостоящим, опасным и проблемным, но все же новым является метод электробромирования, в котором в качестве раствора электролита используется смесь серы, воды и бромистоводородной кислоты. Сера выталкивается на дно емкости под раствором кислоты. Затем используются медный катод и платиновый / графитовый анод, при этом катод находится у поверхности, а анод располагается на дне электролита для подачи тока. Это может занять больше времени и привести к выделению токсичных паров брома / бромида серы, но реагирующая кислота пригодна для повторного использования. В целом в серную кислоту преобразуются только сера и вода (без учета потерь кислоты в виде паров):
- 2 HBr → H 2 + Br 2 (электролиз водного бромистого водорода)
- Br 2 + Br – Br 3 – (начальное образование трибромида, в конечном итоге меняется на противоположное по мере истощения Br -)
- 2 S + Br 2 → S 2 Br 2 (бром реагирует с серой с образованием дибромида дисеры )
- S 2 Br 2 + 8 H 2 O + 5 Br 2 → 2 H 2 SO 4 + 12 HBr (окисление и гидратация дибромида дисеры)
До 1900 года большая часть серной кислоты производилась методом свинцовой камеры. Еще в 1940 году до 50% серной кислоты, производимой в США, производилось на камерных технологических установках.
В начале и середине 19 – го века существовал «купороса» растения, в других местах, в Prestonpans в Шотландии, Шропшир и долине Лагань в графстве Антрим Ирландии, где он был использован в качестве отбеливателя для белья. Раннее отбеливание белья производилось с использованием молочной кислоты из кислого молока, но это был медленный процесс, а использование купороса ускорило процесс отбеливания.
Транспортировка серной кислоты
Перевозка серной кислоты является трудоемким и ответственным мероприятием.
Серная кислота относится к классу опасных химических веществ, и при контакте с кожными покровами вызывает мощнейшие ожоги. Вдобавок, она может стать причиной химического отравления человека. Если при транспортировке не будут соблюдены определенные правила, то серная кислота по причине своей взрывоопасности может причинить немало вреда, как людям, так и окружающей среде.

Серной кислоте присвоен 8 класс опасности и перевозку должны осуществлять специально обученные и подготовленные профессионалы
Важное условие доставки серной кислоты – соблюдение специально разработанных Правил перевозки опасных грузов
Перевозка автомобильным транспортом осуществляется согласно следующим правилам:
- Под перевозку изготавливают специальные емкости из особого стального сплава, не вступающего в реакцию с серной кислотой или титана. Такие емкости не окисляются. Опасную серную кислоту перевозят в специальных сернокислотных химических цистернах. Они отличаются по конструкции и при перевозке подбираются в зависимости от вида серной кислоты.
- При перевозке дымящейся кислоты берутся специализированные изотермические цистерны-термосы, в которых для сохранения химических свойств кислоты поддерживается необходимый температурный режим.
- Если перевозится обычная кислота, то выбирается сернокислотная цистерна.
- Перевозка серной кислоты автотранспортом, таких видов как дымящаяся, безводная, концентрированная, для аккумуляторов, гловерная осуществляется в специальной таре: цистернах, бочках, контейнерах.
- Перевозкой опасного груза могут заниматься исключительно водители, у которых на руках есть свидетельство АДР.
- Время в пути не имеет ограничений, так как при перевозке нужно строго придерживаться допустимой скорости.
- При перевозке строится специальный маршрут, который должен пролегать, минуя места большого скопления людей и производственные объекты.
- Транспорт должен иметь специальную маркировку и знаки опасности.
Получение серной кислоты
Производство серной кислоты в промышленных масштабах было запущено в XV веке, но в то время ее называли “купоросное масло». Если раньше человечество потребляло всего лишь несколько десятков литров серной кислоты, то в современном мире исчисление идет на миллионы тонн в год.
https://youtube.com/watch?v=wvoX4R-kKxE
Производство серной кислоты осуществляется промышленным способом, и их существует три:
- Контактный способ.
- Нитрозный способ
- Другие методы
Поговорим подробно о каждом из них.
Контактный способ производства
Контактный способ производства – самый распространенный, и он выполняет следующие задачи:
- Получается продукт, удовлетворяющий потребности максимального количества потребителей.
- Во время производства сокращается вред для окружающей среды.
При контактном способе в качестве сырья используются такие вещества:
- пирит (серный колчедан);
- сера;
- оксид ванадия (это вещество вызывает роль катализатора);
- сероводород;
- сульфиды различных металлов.
Перед запуском процесса производства сырье предварительно подготавливают. Для начала в специальных дробильных установках колчедан подвергается измельчению, что позволяет, благодаря увеличению площади соприкосновения активных веществ, ускорить реакцию. Пирит подвергается очищению: его опускают в большие емкости с водой, в ходе чего пустая порода и всевозможные примеси всплывают на поверхность. В конце процесса их убирают.
Производственную часть разделяют на несколько стадий:
- После дробления колчедан очищают и отправляют в печь – там при температуре до 800 °C происходит его обжиг. По принципу противотока в камеру снизу идет подача воздуха, и это обеспечивает нахождение пирита в подвешенном состоянии. На сегодняшний день, на этот процесс тратится несколько секунд, а вот раньше на обжиг уходило несколько часов. В процессе обжига появляются отходы в виде оксида железа, которые удаляются, и в дальнейшем передаются на предприятия металлургической промышленности. При обжиге выделяются водные пары, газы O2 и SO2. Когда завершится очистка от паров воды и мельчайших примесей, получается чистый оксид серы и кислород.
- На второй стадии под давлением происходит экзотермическая реакция с использованием ванадиевого катализатора. Запуск реакции начинается при достижении температуры 420 °C, но ее могут повысить до 550 °C с целью увеличения эффективности. В процессе реакции идет каталитическое окисление и SO2 становится SO3.
- Суть третьей стадии производства такова: поглощение SO3 в поглотительной башне, в ходе чего образуется олеум H2SO4. В таком виде H2SO4 разливается в специальные емкости (она не вступает в реакция со сталью) и готова ко встрече с конечным потребителем.
В ходе производства, как мы уже говорили выше, образуется много тепловой энергии, которая используется в отопительных целях. Многие предприятия по производству серной кислоты устанавливают паровые турбины, которые использую выбрасываемый пар для вырабатывая дополнительной электроэнергии.
Нитрозный способ получения серной кислоты
Несмотря на преимущества контактного способа производства, при котором получается более концентрированная и чистая серная кислота и олеум, достаточно много H2SO4 получают нитрозным способом. В частности, на суперфосфатных заводах.
Для производства H2SO4 исходным веществом, как в контактном, так и в нитрозном способе выступает сернистый газ. Его получают специально для этих целей посредством сжигания серы или обжигом сернистых металлов.
Переработка сернистого газа в сернистую кислоту заключается в окислении двуокиси серы и присоединении воды. Формула выглядит так:
SO2 + 1|2 O2 + H2O = H2SO4
Но двуокись серы с кислородом не вступает в непосредственную реакцию, поэтому при нитрозном методе окисление сернистого газа осуществляют при помощи окислов азота. Высшие окислы азота (речь идет о двуокиси азота NO2, трехокиси азота NO3) при данном процессе восстанавливаются до окиси азота NO, которая впоследствии опять окисляется кислородом до высших окислов.
Получение серной кислоты нитрозным способом в техническом плане оформлено в виде двух способов:
- Камерного.
- Башенного.
Нитрозный способ имеет ряд достоинств и недостатков.
Недостатки нитрозного способа:
- Получается 75%-ная серная кислота.
- Качество продукции низкое.
- Неполный возврат оксидов азота (добавление HNO3). Их выбросы вредны.
- В кислоте присутствуют железо, оксиды азота и прочие примеси .
Достоинства нитрозного способа:
- Себестоимость процесса более низкая.
- Возможность переработки SO2 на все 100%.
- Простота аппаратурного оформления.
Применение в народном хозяйстве
Достижения химии всегда служили научно-техническому прогрессу. Высокие окислительные способности позволили H2SO4 стать важным компонентом в ряде отраслей промышленности. Её используют:
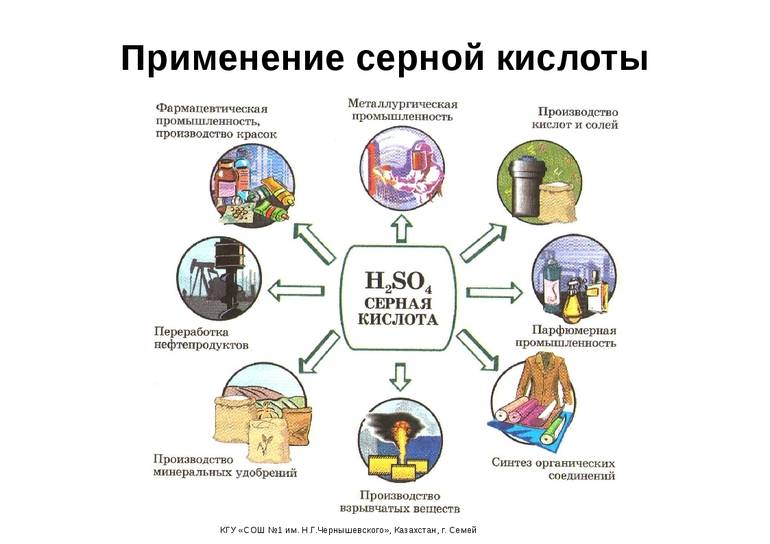
- добыча редких элементов (очистка урановых, иридиевых, циркониевых и осмиевых руд);
- производство минеральных удобрений, высокомолекулярных нитей, красок и пиротехники;
- неорганический синтез солей и кислот;
- текстильная и кожевенная отрасли;
- нефтехимия и металлообработка;
- пищевая промышленность (добавка-эмульгатор E513);
- автомобилестроение (электролит в аккумуляторах);
- дистиллирование воды (реагент для восстановления смол в фильтрах).
Отдельно стоит упомянуть промышленный органический синтез — источник эфиров и спиртов, синтетических моющих средств и искусственных волокон. Он немыслим реакций дегидратации, гидратации, сульфирования, алкилирования. Металлообрабатывающие заводы очищают поверхности изделий от окислов, образующихся при сильном нагревании. Но основным потребительским сегментом является изготовление минеральных удобрений (больше всего — фосфорных). Из-за этого сернокислотные заводы рекомендуется размещать недалеко от предприятий по производству этих ценных химических продуктов.
Все приведённые положительные характеристики были бы неполными, если не вспомнить, что серная кислота и олеум — опасные, чрезвычайно агрессивные продукты. Атмосферные кислотные аэрозоли периодически образуются в результате выбросов металлургических и химических заводов и выпадают в виде осадков. Они поражают кожу и слизистые, что приводит к затруднению дыхания, провоцирует кашель и бронхолёгочные заболевания с отёками гортани.
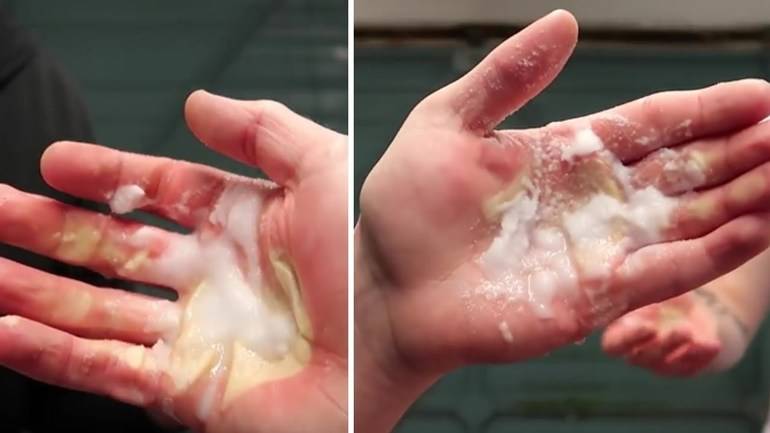
При попадании на кожные покровы возникают химические ожоги, их тяжесть напрямую зависит от концентрации и площади контакта. При проглатывании появляются резкие боли во рту и пищеводе, затем начинается рвота, кашель, затрудняется дыхание и ослабляется сердечная деятельность, а смертельной считается доза 5 мг. Первая помощь при отравлении парами заключается в обеспечении притока свежего воздуха и промывании слизистых содовым раствором. При растекании по коже поражённое место обильно орошают водой, а проглатывание требует промывания желудка и приёма известковой воды.