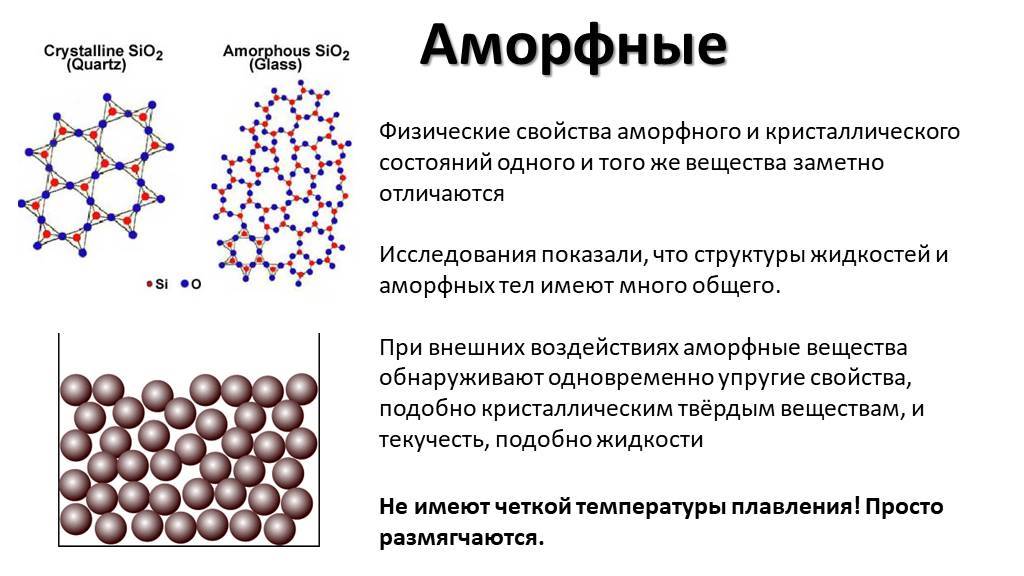
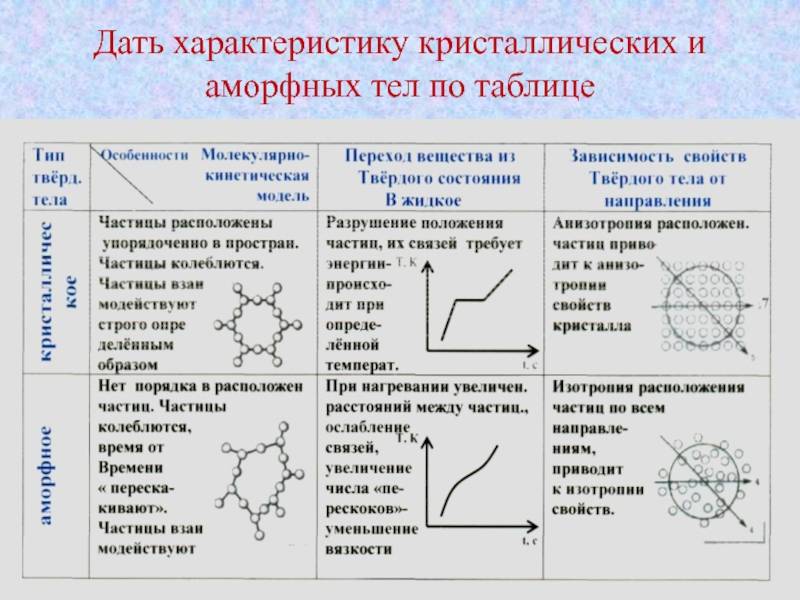
Физические свойства
Аморфные тела, в отличие от кристаллических, не обладают долгоранжистой или периодической структурой, что определяет их основные физические свойства.
Одно из основных отличий между аморфными и кристаллическими телами заключается в их оптических свойствах. Аморфные материалы, будучи анизотропными, обладают случайным распределением индекса преломления в пространстве, что приводит к рассеянию света во всех направлениях. Кристаллические материалы, напротив, имеют предсказуемый индекс преломления, что позволяет им обладать определенной прозрачностью и возможностью преломления света.
Также аморфные материалы имеют более высокую плотность, чем кристаллические, что объясняется их более плотной упаковкой атомов в пространстве. Из-за этого аморфные материалы обладают повышенной твердостью и прочностью.
Еще одним важным физическим свойством аморфных тел является их высокая вязкость. В отличие от кристаллических материалов, аморфные имеют меньшую подвижность атомов, что приводит к более высокой вязкости
Это свойство может быть использовано, например, при производстве стекол и пленок, где важно иметь возможность легко формировать их в нужную форму и препятствовать их деформации в процессе использования
| Свойство | Аморфные тела | Кристаллические тела |
|---|---|---|
| Структура | Нерегулярная | Регулярная |
| Индекс преломления | Случайное распределение | Предсказуемый |
| Плотность | Более высокая | Более низкая |
| Твердость | Повышенная | Обычная |
| Вязкость | Высокая | Низкая |
Таким образом, физические свойства аморфных тел определяются их структурой, отличающейся от кристаллической, и включают оптические свойства, плотность, твердость и вязкость.
Твердость и ломкость
В кристаллических материалах атомы или молекулы располагаются в регулярной упорядоченной структуре, что придает им большую твердость. Кристаллические тела обычно являются твердыми и прочными. Они образуют кристаллы с определенными гранями и плоскостями.
В отличие от этого, аморфные тела не имеют регулярной кристаллической структуры, и их атомы или молекулы располагаются хаотично. Из-за этого аморфные материалы обладают меньшей твердостью. Они склонны к деформациям, царапинам и образованию сколов.
С другой стороны, аморфные тела обычно более прочные в направлении удаления атомов или молекул от плоскости структуры. Это связано с отсутствием сильных связей между атомами или молекулами в регулярной структуре кристаллических материалов. Поэтому, хотя аморфные материалы обладают меньшей твердостью, они могут быть более устойчивыми к разрушениям в определенных условиях.
Таким образом, твердость и ломкость являются важными свойствами материалов, отличающими кристаллические и аморфные тела. Кристаллические материалы обычно более твердые и менее склонные к деформациям, в то время как аморфные материалы обладают меньшей твердостью, но могут быть более прочными в некоторых случаях.
Проводимость
Аморфные тела имеют низкую проводимость по сравнению с кристаллическими структурами. Это связано с их хаотической и неупорядоченной структурой. В аморфных материалах электроны испытывают сложности при движении через материал из-за отсутствия определенных кристаллических направлений.
Кристаллические тела, напротив, имеют более высокую проводимость благодаря упорядоченной и регулярной структуре. Электроны могут свободно передвигаться по кристаллической решетке и эффективно проводить электрический ток.
Важно отметить, что проводимость аморфных и кристаллических материалов может зависеть от различных факторов, таких как тип и концентрация дефектов в структуре, температура и состав материала
Пластичность и хрупкость
Есть ряд материалов, которые претерпевают деформацию при небольшом внешнем воздействии. Это свойство пластичности, которое отличает аморфные твердые тела.
Другая группа материалов – это материалы, способные разрушиться при незначительном воздействии. Это свойство хрупкости, оно на практике оказывается более востребованным, чем упругость и пластичность. Одним из наиболее хрупких материалов является фарфор. Нам известно, что будет с фарфоровым предметом, если уронить его с высоты.
Один и тот же материал условно способен приобретать упругость или пластичность зависимо от возникающих напряжений. У разных материалов свой предел прочности: при определенной нагрузке происходит разрыв материала. В таком случае говорят, что напряжение в этом момент достигло своего максимального значения. Эта величина зависит от материала и качества его обработки.
Переходные между кристаллическим и аморфным состояниями
Когда кристаллическое вещество нагревается достаточно быстро, структура его может не успеть перестроиться в соответствии с новыми условиями и остается более беспорядочной. Это приводит к образованию аморфной фазы.
Однако при медленном охлаждении аморфной фазы твердого вещества может происходить обратный процесс, а именно кристаллизация. При этом атомы или молекулы начинают упорядочиваться в регулярные кристаллические решетки.
Другим способом получения переходных структур является механическое воздействие на кристаллическое вещество. При проведении деформации кристаллизованный материал может переходить в аморфное состояние. Это происходит из-за нарушения исходного порядка в решетке и дезорганизации атомов.
Существуют также вещества, которые могут образовывать переходными структурами уже при нормальных условиях. Это происходит из-за смешивания аморфных и кристаллических фаз, что приводит к появлению промежуточного состояния.
Таким образом, переходные между кристаллическим и аморфным состояниями вещества могут образовываться за счет термической обработки, механического воздействия или из-за особенностей структуры и химического состава вещества.
| Способ формирования переходных структур | Примеры таких веществ |
|---|---|
| Термическая обработка | Стекло, аморфный кремний |
| Механическое воздействие | Нержавеющая сталь после обработки молотом |
| Особенности структуры и состава вещества | Некоторые полимеры, биологические материалы |
Кристаллическая решетка: типы и характеристики
Существуют различные типы кристаллической решетки, которые можно классифицировать на основе их геометрической структуры:
- Кубическая решетка – основной тип решетки, характеризуется тем, что оси a, b и c равны между собой и перпендикулярны. Внутри этой решетки атомы/молекулы находятся в угловых точках куба или ромбоэдра.
- Тетрагональная решетка – оси a и c равны, а ось b перпендикулярна им. Атомы/молекулы располагаются в вершинах прямоугольной призмы.
- Гексагональная решетка – оси a и b равны, а ось c перпендикулярна им. Атомы/молекулы находятся в углах шестиугольной призмы.
- Орторомбическая решетка – все три оси (a, b и c) различны и перпендикулярны. Атомы/молекулы располагаются на углах параллелепипеда.
- Моноклинная решетка – оси a и c различны, а ось b перпендикулярна им. Атомы/молекулы располагаются в углах наклонного параллелепипеда.
- Триклинная решетка – все три оси (a, b и c) различны и неперпендикулярны. Атомы/молекулы находятся в углах нерегулярного параллелепипеда.
Каждый тип решетки имеет свои уникальные характеристики, такие как длины осей, углы между ними, расстояния между атомами/молекулами и их распределение в пространстве. Эти характеристики определяют множество свойств кристалла и его способность проявлять различные физические и химические свойства.
Изучение кристаллической решетки является важной задачей в материаловедении и сыграло ключевую роль в развитии различных технологий, таких как электроника, оптика и катализ. Понимание структуры и свойств кристаллических материалов позволяет улучшить их производство и использование в различных областях науки и промышленности
Что мы узнали?
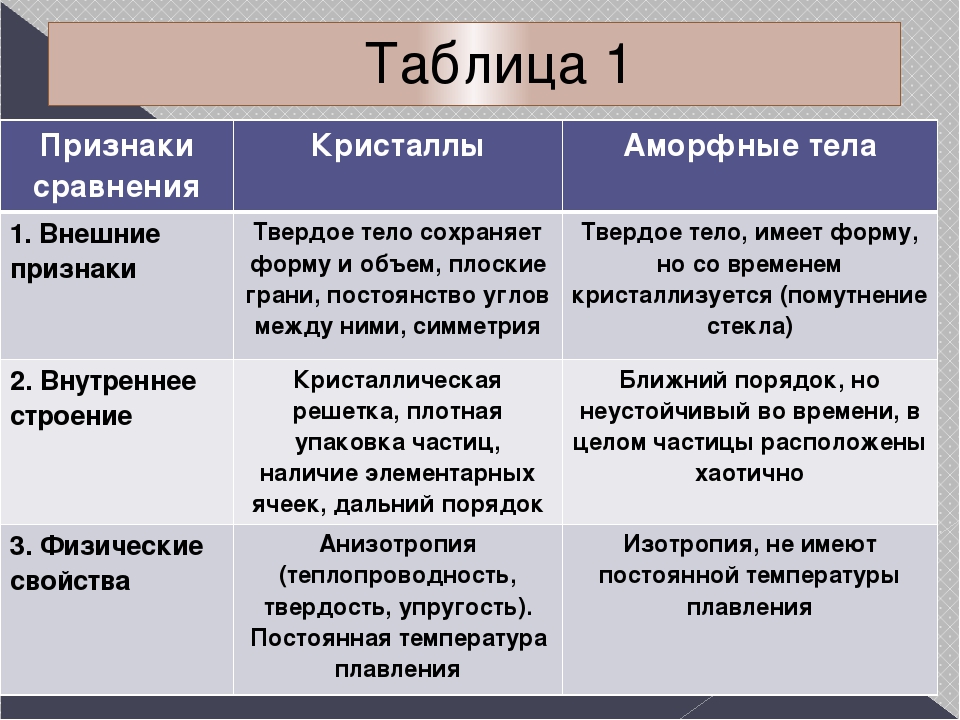
Итак, мы узнали, что кристаллические и аморфные тела кроме общих признаков, которые относят их к твердым телам, имеют совершенно разные физические свойства. Аморфные тела обладают изотропными свойствами, а для кристаллов характерна анизотропия физических параметров. Кристаллические тела делятся на монокристаллы и поликристаллы.
Любое вещество может существовать в трёх агрегатных состояниях: твёрдом, жидком и газообразном. Всем известно, что жидкая при комнатной температуре вода становится твёрдой при охлаждении до \(0\) °С, а при нагревании до \(100\) °С превращается в пар.
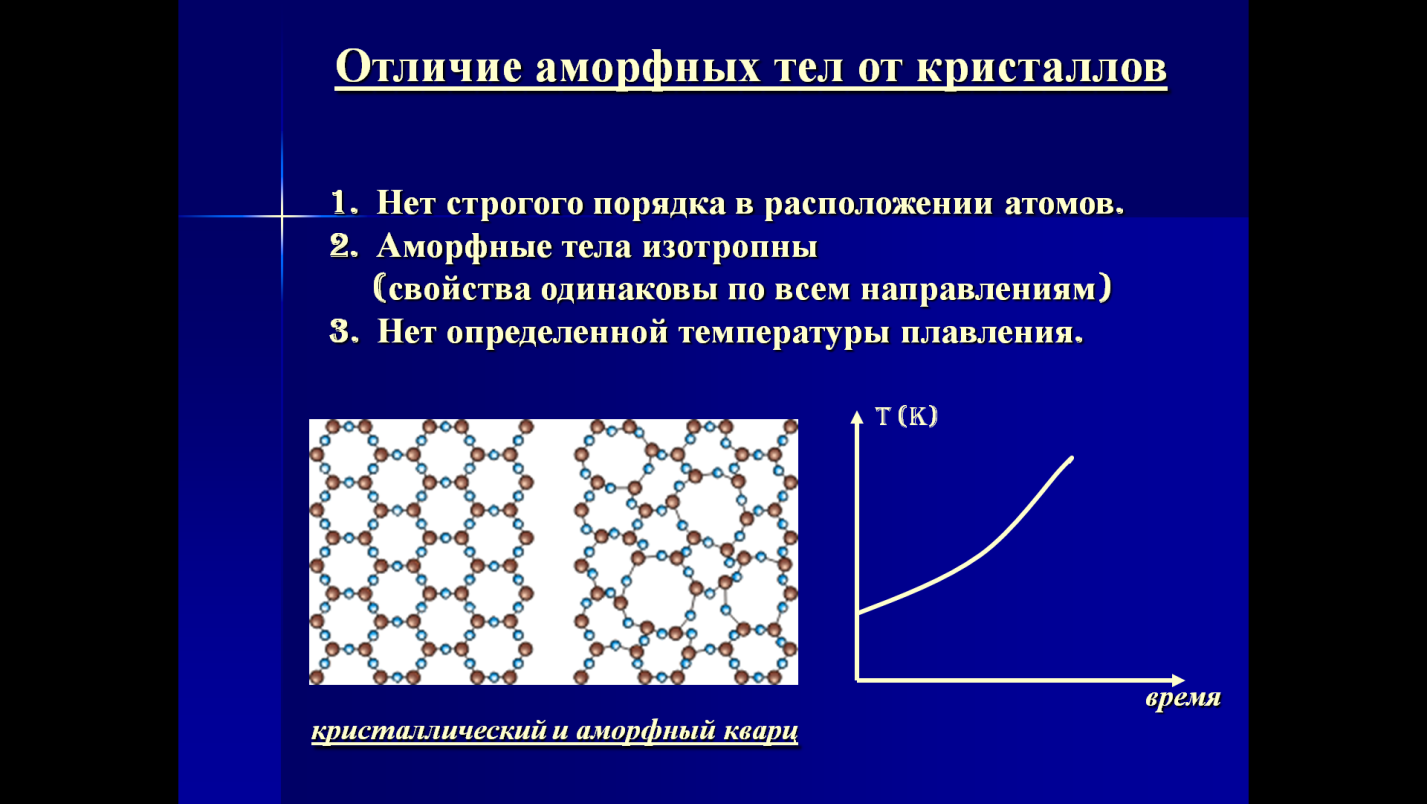
Отличие аморфных и кристаллических веществ заключается в степени упорядоченности их внутреннего строения.
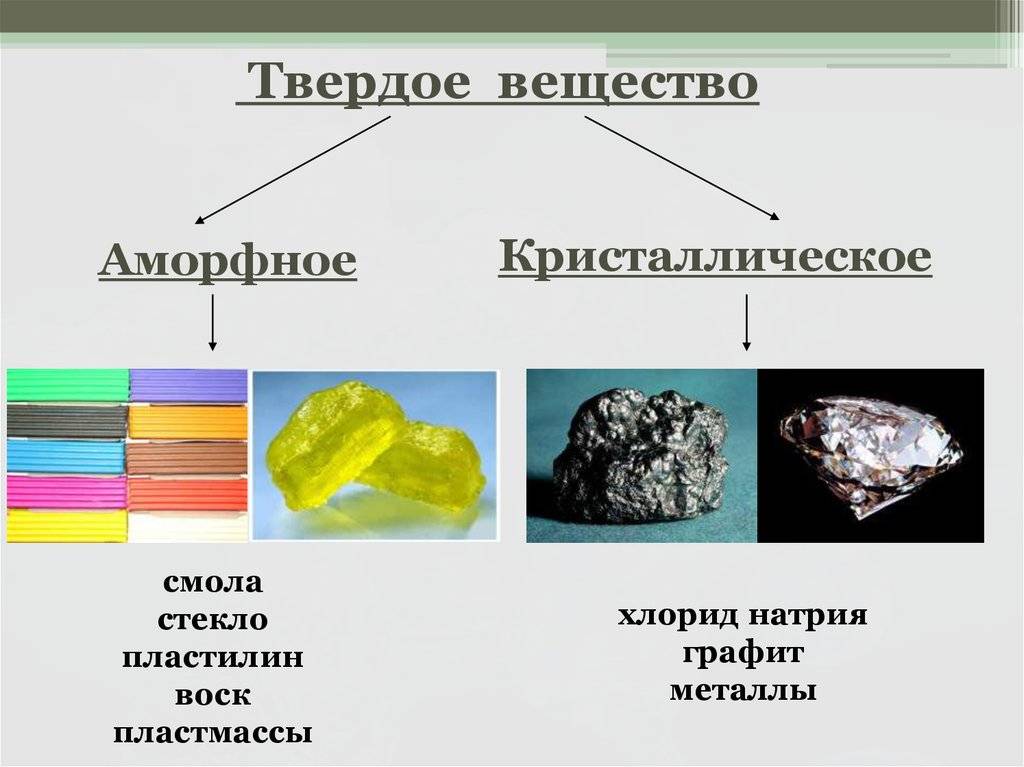
Примеры кристаллических веществ: алмаз , сахар , металлы , соли , щёлочи , большинство оксидов и простых веществ .
К аморфным веществам относятся: стекло , смола , воск , янтарь , пластилин , жевательная резинка , большинство пластмасс .
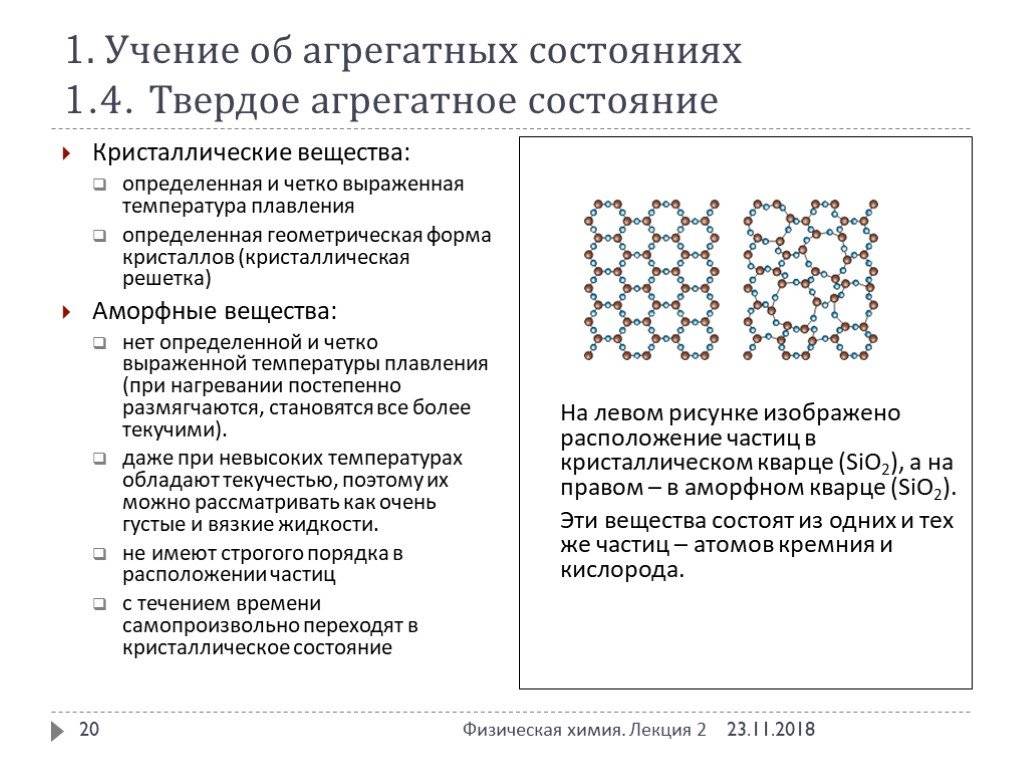
Кристаллические вещества имеют определённую температуру плавления , при которой они сразу становятся жидкими. Например, алюминий плавится при температуре \(660\) °С, а алмаз — при \(3827\) °С.
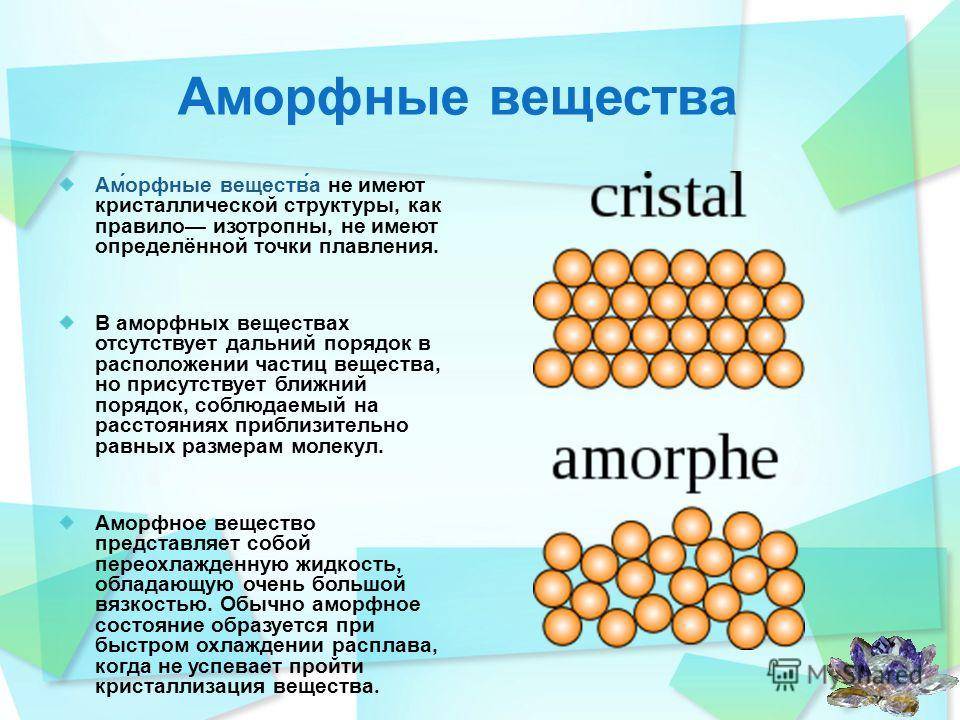
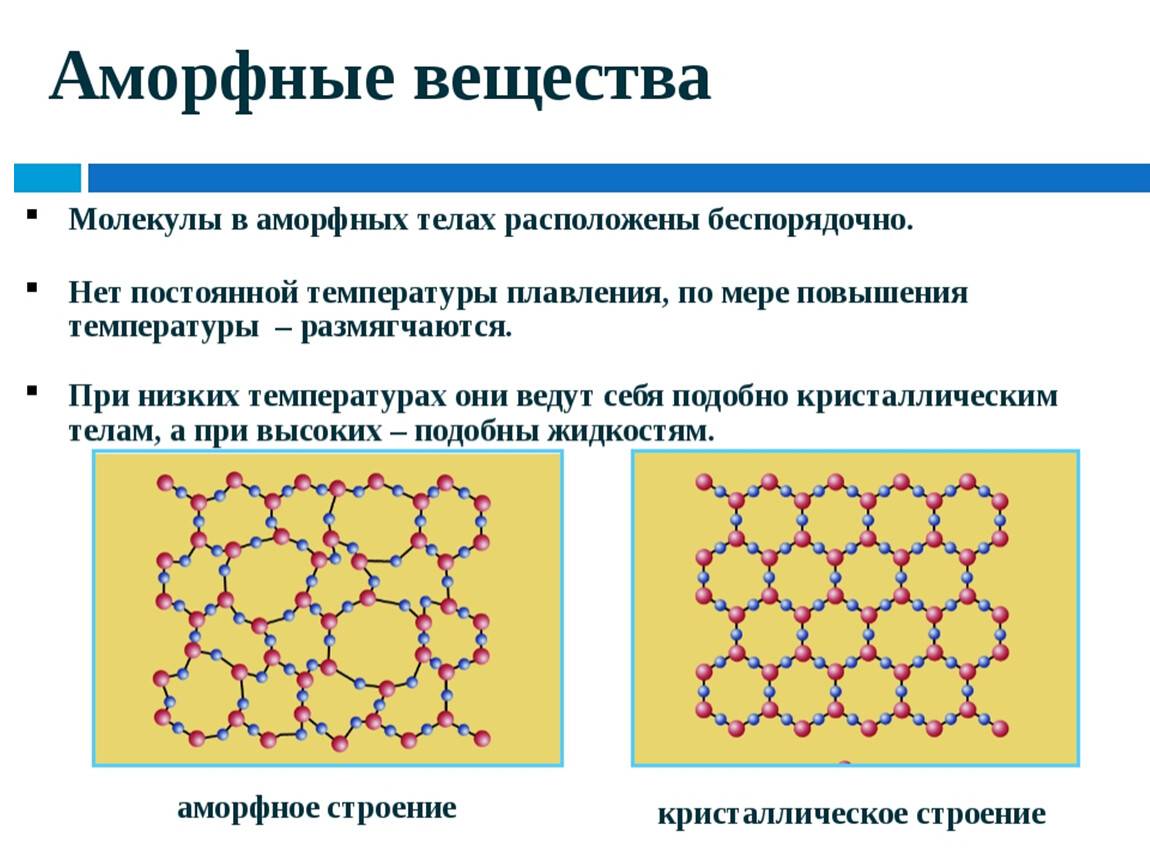
Аморфные вещества не имеют точной температуры плавления — при нагревании они постепенно размягчаются и переходят в вязкое состояние. Способность аморфных веществ становиться вязкими при нагревании позволяет придавать им любую форму .
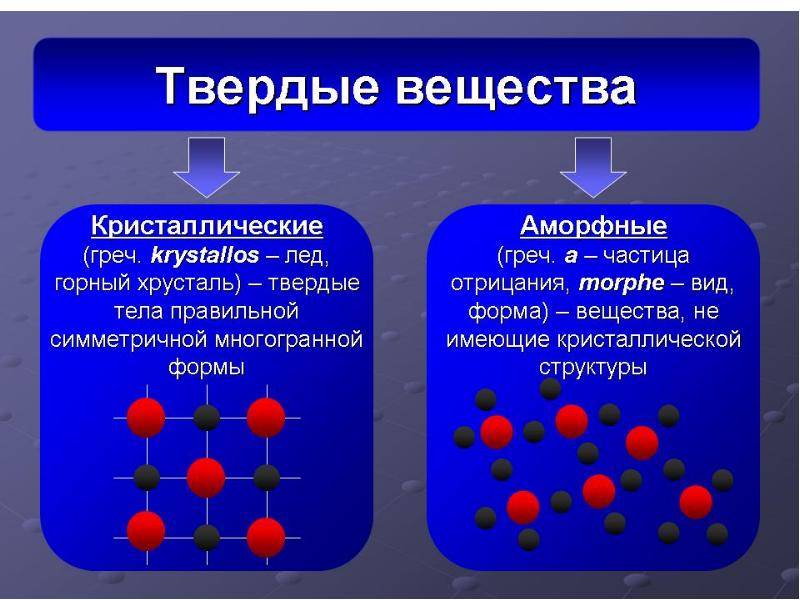
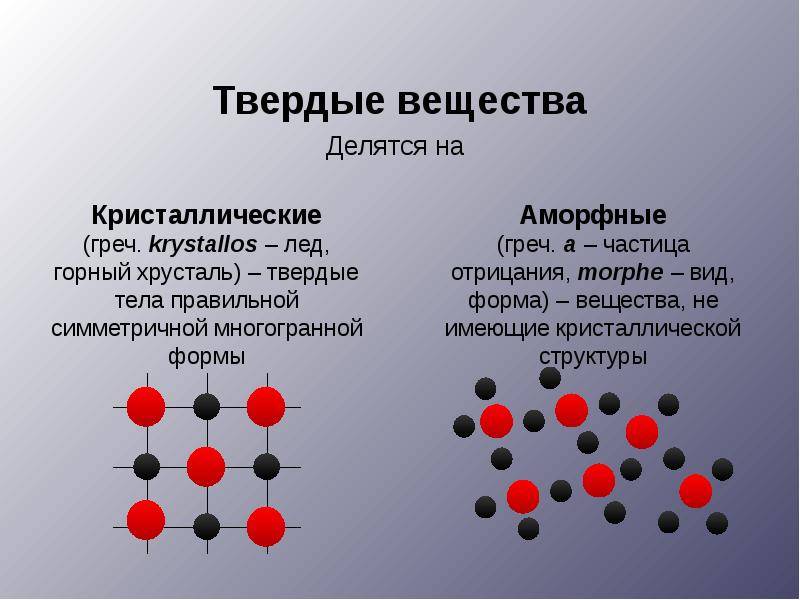
В физике и химии существует такое понятие как твердые тела. Основными свойствами твердых тел являются возможности сохранения объема и формы. По типу внутреннего строения они делятся на кристаллические и аморфные. К первым относятся поваренная соль, металлы, сахар, графит, минералы и т.д., ко вторым – стекло, смолы, пластмассы, воск и т.д. Чем же отличаются аморфные вещества от кристаллических?
Кристаллическое строение отличается упорядоченностью и значительным расстоянием между частицами. Вещества, атомы и молекулы которых расположены более хаотично и на близком расстоянии, называются аморфными. По своему строению они близки к жидкостям.
Существует способ визуального определения кристаллических и аморфных тел: на изломе кристаллы имеют плоские грани и ступенчатую поверхность, в то время как аморфные тела образуют поверхность неправильной формы.
Аморфное состояние веществ считается неустойчивым. Многие такие тела со временем могут стать кристаллами. К примеру, расплавленный сахар при застывании приобретает твердое состояние. И наоборот, некоторые тела с кристаллическим строением при нагревании пребывают в аморфном состоянии.
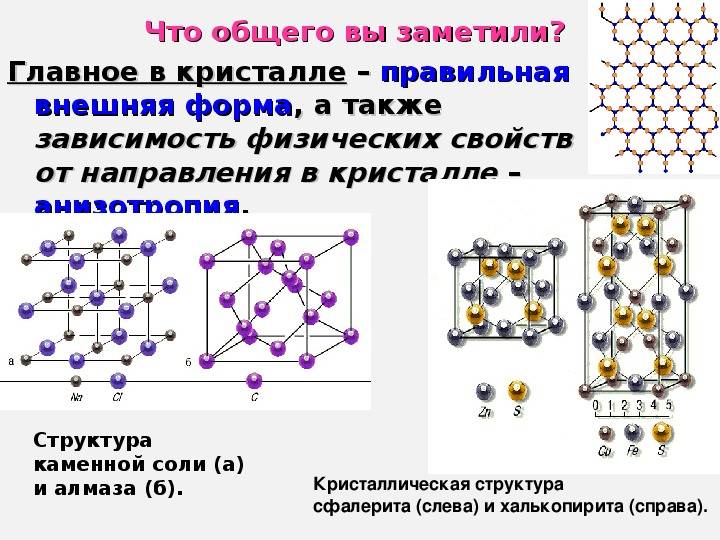
а) кристаллическое вещество б) аморфное вещество
Атомы и молекулы, образующие кристаллическое тело, располагаются в виде разнообразных пространственных решеток, напоминающих геометрические формы. К примеру, монокристалл поваренной соли выглядит как куб, а алмаза – как правильный шестигранник. В естественных природных условиях монокристаллы встречаются редко. Как правило, большинство кристаллических тел состоит из малых, беспорядочно сросшихся между собой, монокристаллов. Такое тело получило название поликристалл.
Монокристаллы зависят от направления ориентации кристаллических граней. Данное свойство называется анизотропией. Поликристаллы же изотропны по своим свойствам, что обусловлено хаотичностью ориентации монокристаллов, из которых они состоят.
Курсы финансового анализа высшая школа экономики
Цветкова экология для начальной школы игры и проекты
Кто такой агроном кратко для детей
Методика обучения в начальной школе кто создатель основ
- План работы с детьми в адаптационный период в доу в таблице
Структурные особенности кристаллических тел
Кристаллические тела представляют собой материалы, структура которых обладает долгоразмерным порядком в расположении атомов или молекул. Это означает, что атомы или молекулы в кристаллическом теле упорядочены в регулярную решетку.
Основными характеристиками структуры кристаллических тел являются:
1. Цельность – все атомы или молекулы, составляющие кристаллическую решетку, образуют единую структурную единицу. Это означает, что взаимное расположение атомов или молекул внутри кристаллического тела одинаково на больших расстояниях.
2. Периодичность – структура кристалла повторяется в пространстве с периодичностью. Это значит, что кристалл можно представить как упорядоченную систему из однокубических нанометровых блоков, называемых элементарными ячейками.
3. Симметрия – у кристаллических тел часто наблюдается симметричная атомная или молекулярная решетка. Симметрия может быть отражательной, поворотной или поворотно-отражательной. Она определяет углы и длины связей между атомами или молекулами в кристаллической структуре.
4. Однозначность – структура кристаллического тела является однозначной и может быть полностью определена заданием значений индексов отражений в решетке Бравэ.
5. Дефекты – в кристаллической решетке могут наблюдаться дефекты, такие как примеси, вакансии, дислокации и т.д. Они влияют на механические, электрические и другие свойства кристалла.
Структурные особенности кристаллических тел определяют их физические свойства, такие как прозрачность, теплопроводность, оптические свойства и многое другое. Кристаллические материалы широко используются в различных отраслях науки и промышленности благодаря своим уникальным свойствам и возможностям.
Особенности твердых веществ
По характеру движения электронов на внешнем уровне атомов твердого тела можно установить его электрические специфические свойства и признаки. Сегодня выделяют несколько видов таких тел в зависимости от типа связи атомов.
При ионной связи атомов основной характерной чертой стала сила электростатического притяжения. Такие вещества способны отражать и поглощать свет в инфракрасной плоскости. При небольшой температуре ионная связь отличается малой электропроводностью.
Ковалентная связь осуществляется за счет электронной пары. Она принадлежит обоим атомам. Подобная связь также делится на простую, двойную и тройную по наличию числа пар электронов. Наиболее твердые кристаллы относятся к ковалентной связи.
Металлическая связь возникает при возникновении больших атомов. Она образуется при помощи процесса объединения валентных электронов атомов. Большие атомы способны отдавать свои электроны, что способствует формированию сложных соединений. Так образуются металлы и другие сложные твердые вещества. Вещества с металлической связью разнообразны по физическим свойствам. Среди них выделяют жидкие металлы, мягкие, очень твердые.
При молекулярной связи, которая образуется в кристаллах, образуется отдельными молекулами вещества. Силы, при которых происходят процессы, обладают значительной степенью стабильности. Молекулы притягиваются друг относительно друга только слабым межмолекулярным притяжением. При нагревании вещества подобные недолговечные связи утрачивают свою актуальность и разрушаются.
Водородная связь может возникнуть между поляризованными положительно заряженными атомами молекулы и той частью, которая является частью отрицательно поляризованной частицей или ее частью.
Строение и свойства твердых тел.
- В каких агрегатных состояниях может находиться вещество?
- Какие тела называют аморфными?
- Чем отличаются монокристаллы от поликристаллов?
- Что вы понимаете под изотропией и анизотропией?
- Как ведут себя молекулы в твердых телах?
Молекулярное строение твердых тел
Твердое тело имеет собственную форму, не растекается по объему и не принимает его форму. На микроскопическом уровне атомы прикрепляются друг к другу химическими связями, и их положение друг относительно друга фиксировано. При этом они могут образовывать как жесткие упорядоченные структуры — кристаллические решетки.
Кристаллическое тело может состоять из одного кристалла (монокристалл). Может состоять из многих “сросшихся” кристаллов (поликристаллы).
Монокристалл Поликристалл
Монокристаллы обладают анизотропией, поликристаллы изотропны. Анизотропия – различие свойств по разным направлениям. Прежде всего, бросается в глаза различная механическая прочность кристаллов по разным направлениям. Например, кусок слюды легко расслаивается в одном из направлений на тонкие пластинки, но разорвать его в направлении, перпендикулярном пластинкам, гораздо труднее. Так же легко расслаивается в одном направлении кристалл графита. Когда вы пишете карандашом, такое расслоение происходит непрерывно и тонкие слои графита остаются на бумаге. Многие кристаллы по-разному проводят теплоту и электрический ток в различных направлениях. От направления зависят и оптические свойства кристаллов. Так, кристалл алмаза по-разному преломляет свет в зависимости от направления падающих на него лучей.
Молекулы (ионы, атомы), образующие кристаллическую решетку, колеблются около положения узла, отклоняясь на малые, по сравнению с расстоянием между узлами, расстояния. Чем выше температура тела, тем больше размах колебаний молекул. Кинетическая энергия молекул значительно выше потенциальной энергии их взаимодействия.
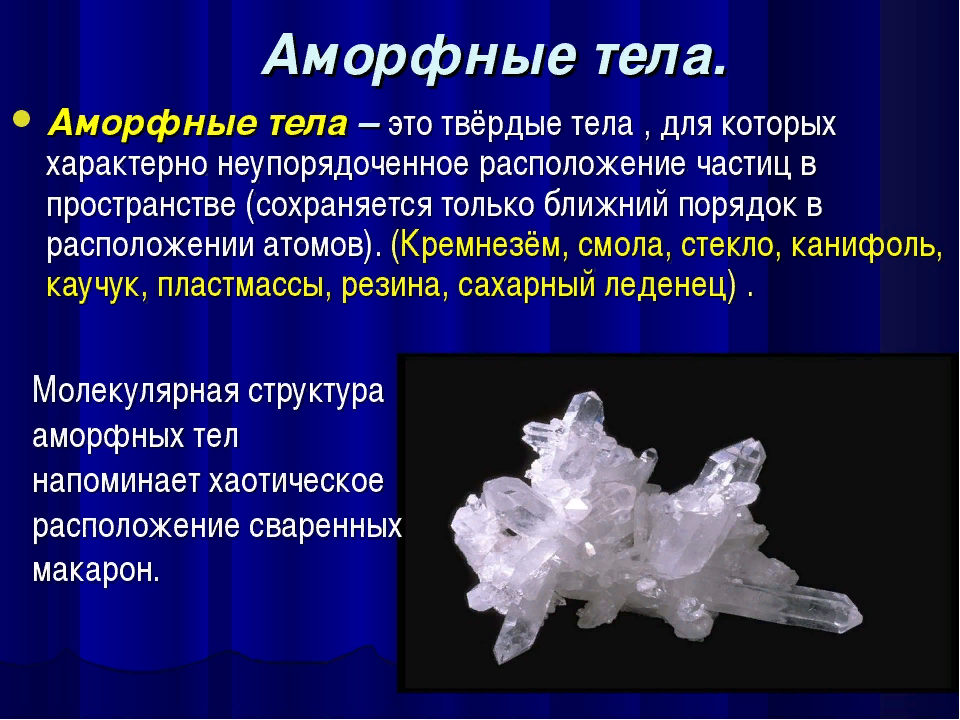
Аморфные тела
Если связанные атомы образуют беспорядочные нагромождения, получим аморфное тело (именно такова структура полимеров, которые похожи на перепутанные и слипшиеся макароны в миске). К аморфным телам относятся стекло, смола, канифоль, сахарный леденец и др.
Следует иметь в виду, что в ряде случаев одно и то же вещество в зависимости от условий его получения может находиться как в кристаллическом, так и в аморфном состоянии. Так как аморфные тела могут самопроизвольно переходить в кристаллическое состояние, следует, что кристаллическая форма вещества более устойчива, чем аморфная.
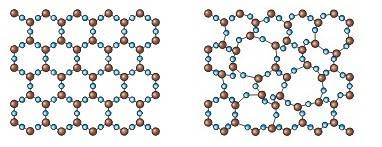
Молекулы кварца: а) кристаллического, б) аморфного.
С точки зрения молекулярного строения аморфные тела следует отнести не к твердым телам – кристаллам, а к жидкостям с очень большой вязкостью.
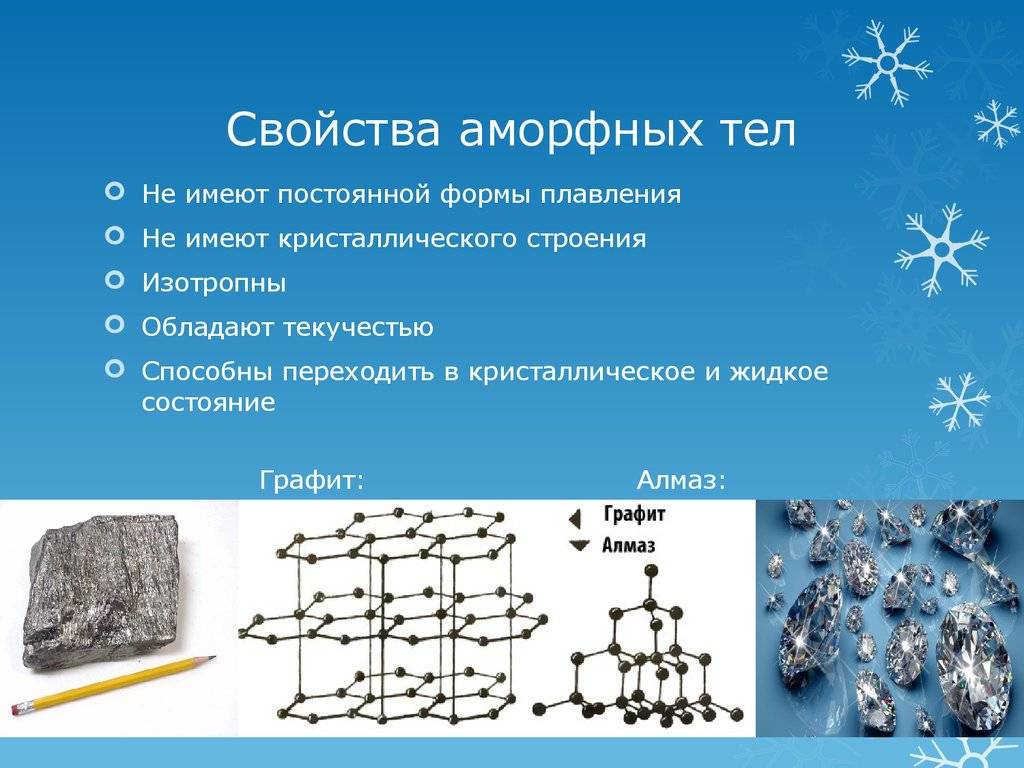
Все аморфные тела изотропные, т.е. их физические свойства одинаковы по всем направлениям.
Молекулы аморфных тел движутся так, как движутся молекулы жидкостей, но их подвижность очень мала.
Жидкие кристаллы
Это фазовое состояние, в которое переходят некоторые вещества при определенных условиях (температура, давление, концентрация в растворе). Жидкие кристаллы обладают одновременно свойствами как жидкостей (текучесть), так и кристаллов (анизотропия).
По структуре представляют собой вязкие жидкости, состоящие из молекул вытянутой или дискообразной формы, определённым образом упорядоченных во всем объёме этой жидкости.
Модель жидкого кристалла
Структура кристаллических материалов
Кристаллические материалы имеют упорядоченную структуру, обусловленную периодическим повторением одного или нескольких блоков в трех измерениях. Эта структура образуется благодаря регулярному расположению атомов, ионов или молекул в кристаллической решетке.
Кристаллическая решетка представляет собой трехмерную атомарную структуру, в которой каждая точка решетки соответствует одному атому, иону или молекуле. Расстояния между точками решетки и их ориентация определяются симметрией кристаллической структуры. В кристаллических материалах можно выделить элементарные ячейки, представляющие собой наименьшую часть решетки, которую можно повторить бесконечное число раз.
Структуры кристаллических материалов могут быть различными, в зависимости от типа взаимодействия между атомами, ионами или молекулами. Существуют кристаллические материалы с простой кубической, гексагональной, кубической гранецентрированной и другими типами структур.
Структура кристаллических материалов влияет на их физические и химические свойства, такие как твердость, прозрачность, электропроводность и теплопроводность. Понимание структуры кристаллических материалов играет важную роль в разработке новых материалов с определенными свойствами и улучшении существующих материалов для различных применений.
Свойства
Аморфные тела:
1. Пористость – аморфные тела часто содержат пористую структуру, что позволяет им иметь большую площадь поверхности и обладать высокой активностью.
2. Пластичность – аморфные тела обладают пластическими свойствами, что позволяет им быть деформированными без кристаллического переупорядочения.
3. Прозрачность – некоторые аморфные вещества, такие как стекло, обладают высокой прозрачностью для видимого света.
4. Отсутствие дефектов решетки – в отличие от кристаллических тел, аморфные тела не имеют дефектов решетки, что может влиять на их механические и оптические свойства.
5. Стекловидность – аморфные тела могут обладать стекловидной структурой, в которой атомы располагаются в беспорядочном порядке, что влияет на их физические свойства.
Кристаллические тела:
1. Регулярное расположение атомов – кристаллические тела имеют регулярное и повторяющееся расположение атомов, что определяет их кристаллическую структуру и свойства.
2. Изотропность или анизотропность – кристаллические тела могут быть изотропными, то есть иметь одинаковые свойства во всех направлениях, или анизотропными, что означает различие свойств в разных направлениях.
3. Точки плавления и кипения – кристаллические тела обычно имеют более высокие точки плавления и кипения по сравнению с аморфными телами, из-за более устойчивой структуры.
4. Регулярные грани и формы – кристаллические тела могут образовывать регулярные грани и формы, такие как куб, октаэдр, пирамида и другие, в зависимости от их кристаллической структуры.
5. Оптические эффекты – кристаллические тела могут обладать оптическими эффектами, такими как двойное лучепреломление, поляризация света или флуоресценция, из-за особенностей их кристаллической структуры.
Кристаллические и аморфные твердые тела
Кристаллическими называют тела, которые обладают особой структурой молекулярных связей между собой. Все частицы в таком исполнении составляют кристалл и расположены в определенном порядке. Расстояние между частицами также определенное. Подобные связи еще называют кристаллической решеткой. Она представляет собой совокупность атомов и различных узлов и молекул, которые составляют твердое вещество в целом.
Статья: Виды твердых тел
Найди решение своей задачи среди 1 000 000 ответов
Подобные соединения славятся очень большой прочностью, а из металлических материалов с классической кристаллической решеткой сегодня строятся самые сложные инженерные сооружения, включая мосты, здания и иные строения. Прочность кристаллических тел отличается высокой степенью практического применения в различных сферах человеческой деятельности. Однако реальная прочность кристаллов оказалось гораздо меньше расчетной прочности, так как на их поверхности обнаружены многочисленные дефекты в основе кристаллической решетки.
Аморфными твердыми телами называют такие тела, которые обладают одинаковыми физическим свойствами по всем направлениям. Подобное свойство также называют изотропностью. Такие аморфные тела характеризуются беспорядочным расположением элементов молекулярной связи. Они состоят из бесконечного количества соединений атомов и молекул. В кристаллических телах внутренняя структура резко контрастирует с аморфными телами
Кристаллические тела делятся на:
- монокристаллы;
- поликристаллы.
Монокристаллы характеризуются периодичностью по своей структуре и многократному повторению связей во всем объеме.
Для поликристаллов основополагающим стало наличие кристаллитов. Они выглядят, как множество сросшихся между собой хаотически расположенных маленьких кристаллов.
Структура кристаллов
Структура кристаллов имеет решетчатую форму и состоит из атомов, молекул или ионов, упорядоченно расположенных в трехмерном пространстве. Кристаллы могут иметь различные формы: плоские, слоистые, волокнистые и т. д. Каждый кристалл обладает уникальными физическими и химическими свойствами, которые определяются его структурой.
Основные характеристики структуры кристаллов:
- Решетка: симметричная система, образованная повторяющимися элементарными ячейками.
- Пространственная группа: набор всех симметричных операций, которые сохраняют структуру кристалла.
- Симметрия: отражение, повороты, вращения и сдвиги, которые сохраняют структуру кристалла.
- Единичная ячейка: наименьшая часть кристаллической решетки, которая полностью повторяет структуру всего кристалла.
- Базис: группа атомов или ионов, размещенных в каждой ячейке и определяющих характер кристаллической структуры.
В основе структуры кристаллов лежит упорядоченность атомов или ионов, что отличает их от аморфных тел. Эта упорядоченность обусловливает особые свойства и поведение кристаллов, такие как преломление света, пьезоэлектричество, ферромагнетизм и другие.
Кристаллические тела
Сейчас мы впервые приступаем к рассмотрению твёрдых тел с точки зрения молекулярно кинетической теории. Конечно же, твёрдые тела разительным образом отличаются от газов, а тем более идеальных газов, по своей структуре и свойствам, однако мы всё равно можем, пользуясь уже имеющимися знаниями, описать их.
Во-первых, вспомним, какое определение твёрдым телам вводилось в младших классах:
Определение. Твёрдые тела – тела, которые со временем не меняют своей формы и объёма. Теперь же для расширения теории о твёрдых телах мы введём классификацию твёрдых тел. Твёрдые тела делятся на…
- Кристаллы (кристаллические тела)
- Аморфные тела
- Композиты (композитные тела) (рис. 1)
Рис. 1. Примеры кристаллических (соль) и аморфных (воск) твёрдых тел соответственно
Рассмотри кристаллические тела:
Определение.Кристаллы – твёрдые тела, у которых наблюдается упорядоченное расположение атомов или молекул (см. рис. 2).
Рис. 2. Пример кристаллической решётки (каменная соль)
Кристаллы, в свою очередь, также делятся на два класса:
1. Монокристаллы, то есть вся структура тела представлена единым кристаллом (алмаз, рубин, сапфир…)
2. Поликристаллы, то есть структура тела представляет собой объёдинение большого количества малых кристаллов (гранит, большинство металлов…)
Следует также знать, что кристаллическая структура не является свойством, характерным для одних химических элементов или соединений, а для других нехарактерным. Дело в том, что многие твёрдые тела обладают так называемым свойством полиморфизма.
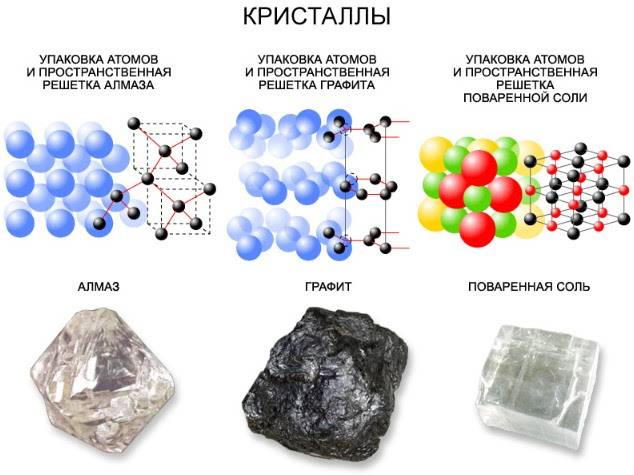
Определение. Полиморфизм – свойство твёрдых тел существовать в состоянии с различной кристаллической решёткой. Например, уже приводимые на одном из прошлых уроков в качестве примера алмаз и графит оба состоят из углерода, однако с различным расположением его атомов.
Кристаллы могут быть распределены на две группы также и по следующим свойствам: изотропия и анизотропия.
Определение. Анизотропия – зависимость физических свойств кристалла от направления. То есть кристаллическая структура не симметрична, и существует несколько осей, вдоль которых у кристалла проявляются различные свойства (механические, электрические, оптические). Анизотропия свойственна монокристаллам.
Изотропия – независимость физических свойств кристалла от направления. Свойственна поликристаллам, потому как несимметрические монокристаллы ориентируются хаотически, сводя на нет несимметричность.
Ещё одним принципом, по которому можно классифицировать кристаллы, является природа связей, которые удерживают узлы кристаллической решётки вместе:
- Молекулярные связи характерны для кристаллов с очень низкой механической твёрдостью (кристаллы на основе водорода и гелия)
- Ковалентные связи характерны, напротив, для кристаллов с высокой прочностью (алмаз)
- Ионные связи (соли)
- Металлические связи (металлы)
Кристаллические тела
Твердые тела, в которых молекулы и атомы расположены упорядоченно и образуют периодически повторяющуюся структуру, называются кристаллами. Физические свойства кристаллов (упругие, механические, тепловые, электрические, магнитные, оптические) в разных направлениях неодинаковы. Такое свойство называется анизотропностью. Анизотропия кристаллов объясняется тем, что при упорядоченном расположении частиц расстояния между ними и силы взаимодействия (притяжения и отталкивания) оказываются неодинаковыми в разных направлениях.
Различают кристаллические тела двух видов: монокристаллы и поликристаллы. Главным признаком монокристаллов является повторяющееся внутреннее строение (структура) во всем объеме тела.
Поликристалл — это совокупность (набор) сросшихся друг с другом, хаотически ориентированных, небольших кристаллов. Каждый маленький кристалл обладает свойствами анизотропии, но их совокупность — поликристалл — изотропен.
Рис. 2. Монокристаллы и поликристаллы.
Часто встречаются кристаллические тела одинаковые по своему химическому составу, но обладающие очень разные физические свойства. Самый известный пример — это углерод, имеющий две модификации: графит и алмаз. Разное строение кристаллических решеток является причиной того, что алмаз имеет рекордные показатели твердости, а графит из-за его мягкости используется в качестве грифелей для карандашей.
Рис. 3. Графит и алмаз.
Что мы узнали?
Итак, мы узнали, что кристаллические и аморфные тела кроме общих признаков, которые относят их к твердым телам, имеют совершенно разные физические свойства. Аморфные тела обладают изотропными свойствами, а для кристаллов характерна анизотропия физических параметров. Кристаллические тела делятся на монокристаллы и поликристаллы.
/5
Вопрос 1 из 5