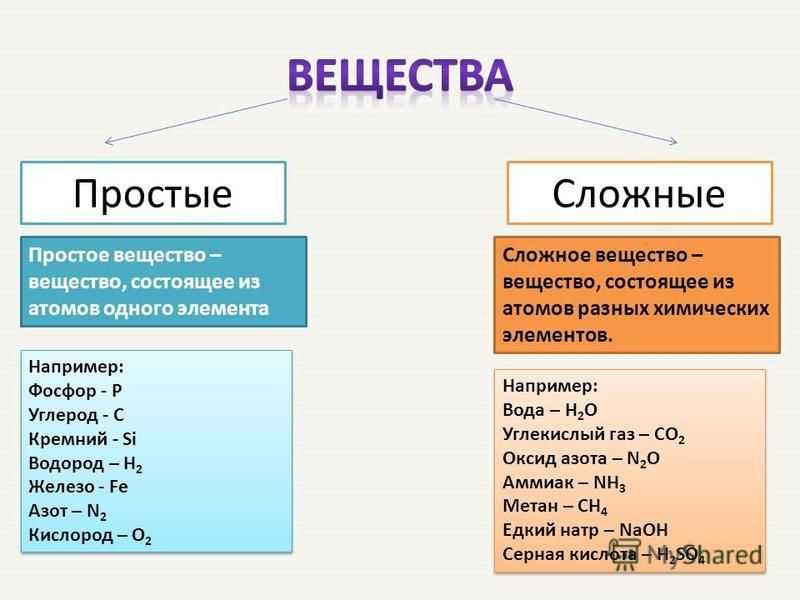
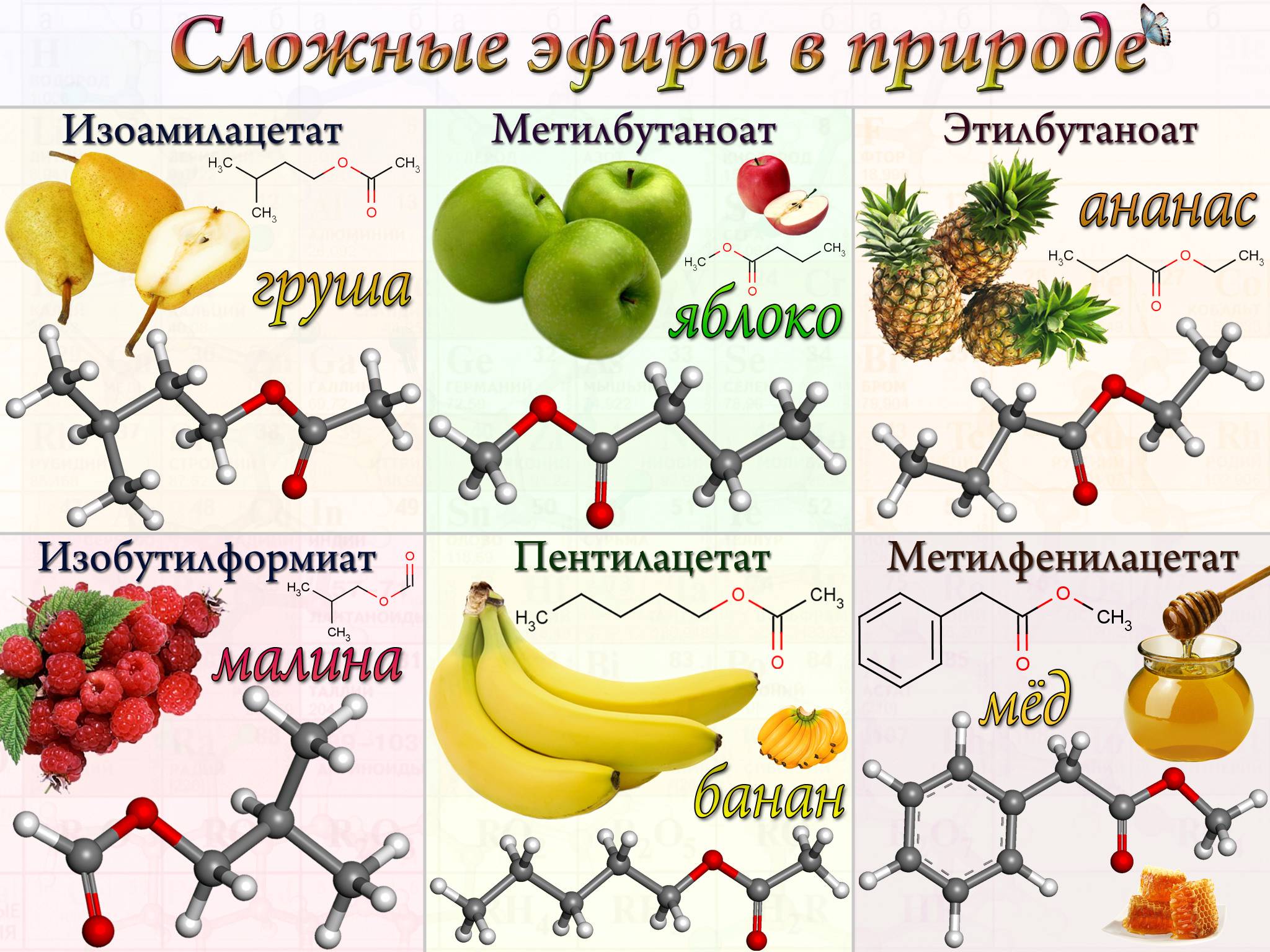
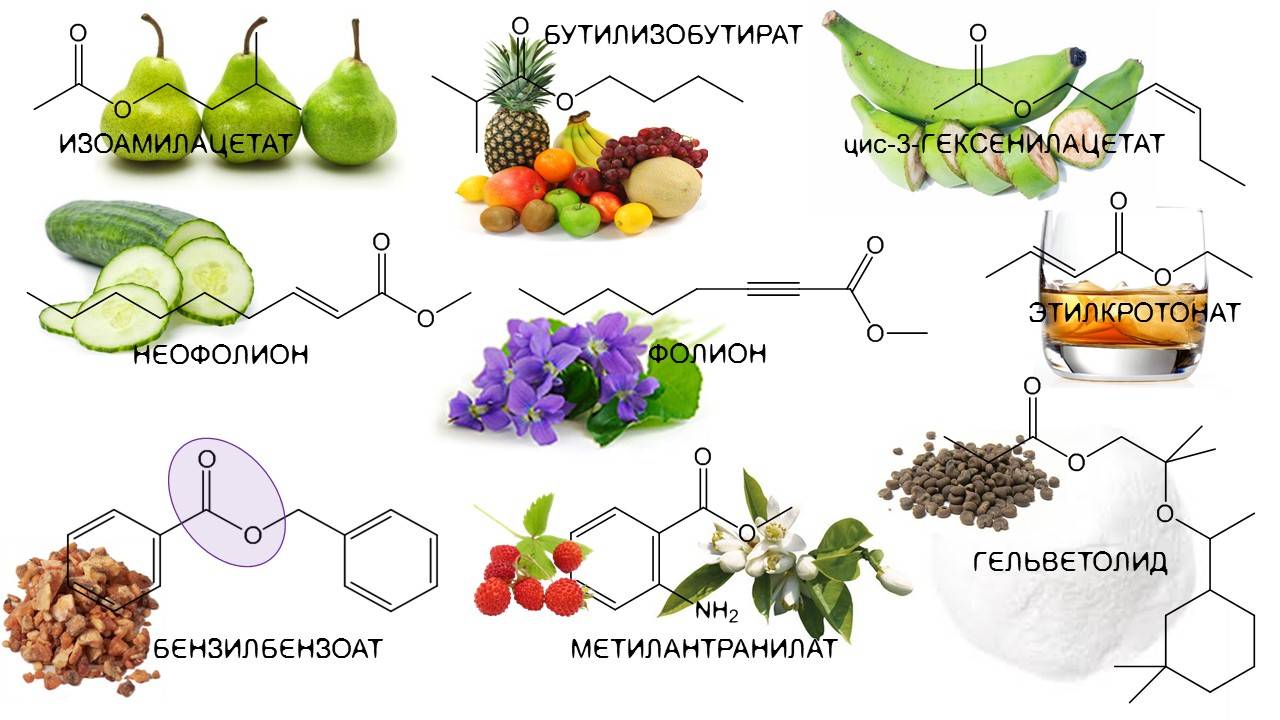
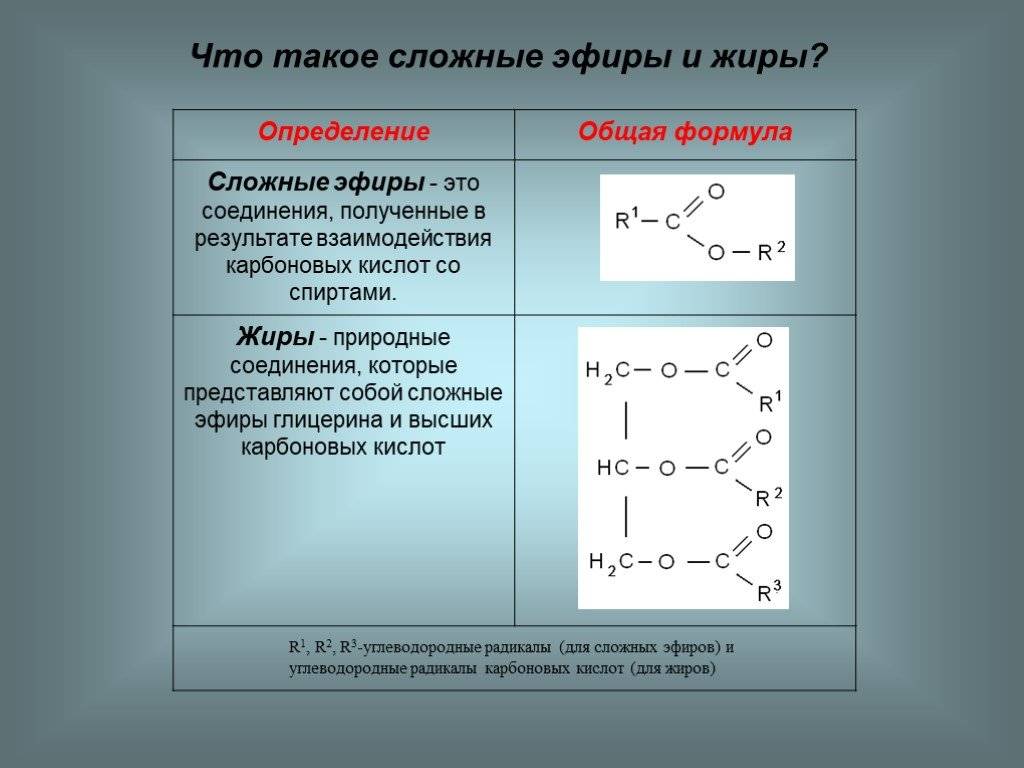
Определение сложных эфиров
Сложные эфиры обычно содержат дополнительные функции и возможности, такие как создание и использование переменных, операторные конструкции, условия и циклы, обработка событий и т.д. Это позволяет разработчикам создавать более мощные и гибкие интерактивные сценарии.
Особенностью сложных эфиров является их структура, которая часто состоит из вложенных блоков и компонентов. Это позволяет упорядочить и организовать код, делая его более понятным и легко поддерживаемым.
Сложные эфиры широко применяются при разработке веб-приложений, анимаций, игр, а также в других областях, где требуется создание интерактивных и динамических интерфейсов.
Важно отметить, что использование сложных эфиров требует от разработчика более глубоких знаний и навыков программирования, поэтому для их создания необходимо обладать соответствующим опытом и экспертизой
Синтез и получение
Также существуют другие методы получения сложных эфиров. Например, эфиры могут быть получены путем реакции алкена с алкоголем в присутствии кислоты или основы. Это позволяет получать эфиры с необычной структурой и свойствами.
Синтез сложных эфиров может также осуществляться путем объединения двух или более молекул с помощью химических реакций. Например, эфиры могут быть получены путем реакции гидролиза эстеров или реакции замещения галогенометилов на алкоголе.
Получение сложных эфиров требует знания и опыта в химическом синтезе. Необходимо проектировать и проводить эксперименты, оптимизировать условия реакций и проводить анализ полученных продуктов. Синтез сложных эфиров играет важную роль в органической химии и находит применение в различных областях, включая фармацевтику, пищевую промышленность и синтез новых материалов.
Физические свойства и строение
Молекула эфира обладает суммарным дипольным моментом из-за полярности связей CO. Температура кипения других сравнима с алканами, но намного ниже, чем у спирта с сопоставимой молекулярной массой, несмотря на полярность связи C-O.
Физические свойства простых и сложных эфиров
Физические свойства простых эфиров
Диметиловый эфир и этилметиловый эфир являются газами при обычной температуре. Другие низшие гомологи представляют собой бесцветные, приятно пахнущие летучие жидкости с типичным запахом эфира.
Точки кипения
Связи C – O в эфире полярны, и, следовательно, эфиры имеют суммарный дипольный момент. Слабая полярность простых эфиров существенно не влияет на их температуры кипения, которые сопоставимы с температурами кипения алкенов с сопоставимой молекулярной массой. Эфиры имеют гораздо более низкие температуры кипения по сравнению с изомерными спиртами. Это происходит потому, что молекулы спиртов связаны водородными связями, в то время как молекулы эфира — нет.
Растворимость
Эфиры, содержащие до 3 атомов углерода, растворимы в воде благодаря образованию у них водородных связей с молекулами воды.
Растворимость уменьшается с увеличением числа атомов углерода. Относительное увеличение углеводородной части молекулы уменьшает тенденцию к образованию Н-связи. Эфиры хорошо растворимы в органических растворителях, таких как спирт, бензол, ацетон и т.д.
Физические свойства сложных эфиров
- Сложные эфиры представляют собой бесцветные жидкости с приятным запахом, в то время как сложные эфиры высших кислот представляют собой бесцветные твердые вещества.
- Низшие эфиры хорошо растворимы в воде. Растворимость сложных эфиров в воде быстро уменьшается с увеличением массы.
- Температуры кипения метиловых и этиловых эфиров ниже, чем у соответствующих исходных кислот.
Строение молекул
Структура молекул простых эфиров
Эфиры представляют собой класс органических соединений, которые содержат sp3-гибридизованный кислород между двумя алкильными группами и имеют формулу R-O-R’. эти соединения используются в красителях, парфюмерии, маслах, восках и других промышленных целях. Алифатические эфиры не имеют арильных групп, непосредственно присоединенных к эфирному кислороду.
Алифатические эфиры
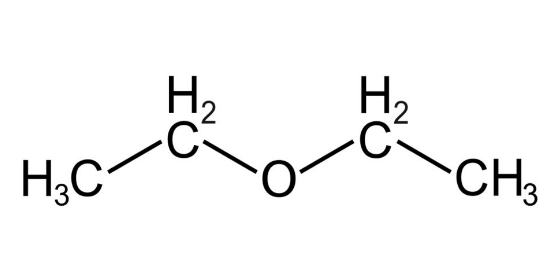
Примеры алифатических эфиров
Ароматические эфиры имеют по меньшей мере одно арильное кольцо, непосредственно присоединенное к эфирному кислороду. В ариловых эфирах одиночные пары, образующиеся на кислороде, сопряжены с ароматическим кольцом, что значительно изменяет свойства эфира.
Ариловые эфиры
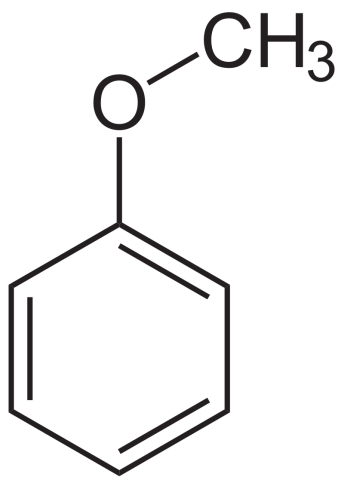
Пример ароматических эфиров
Гибридизация кислорода sp3 дает эфиры примерно той же геометрии, что и спирты и вода. Угол связи R-O-R’ близок к тому, что ожидается в тетраэдрической геометрии. Угол связи диметилового эфира составляет 112o, что больше, чем угол связи H-O-H в воде (104,5 o) из-за стерического отталкивания метильных групп.
Угол эфирной связи
Наличие электроотрицательного атома кислорода придает эфирам небольшой дипольный момент.
Спектральные свойства
Спектроскопия простых эфиров
Инфракрасная спектроскопия
Кислород образует две связи. Атом кислорода может быть найден между двумя атомами углерода, как в дибутиловом эфире.
Бутиловый эфир масляной кислоты + вода → (H+) → масляная кислота + бутанол-1
Если мы посмотрим на ИК-спектр дибутилового эфира, то увидим:
- существуют обычные режимы растяжения sp3 C-H и изгиба \(CH_2\) при 2900 и 1500 см-1;
- наблюдается сильный пик около 1000 см-1. Этот пик обусловлен вибрацией растяжения C-O.
Рисунок ИК. ИК-спектр дибутилового эфира
ЯМР-спектроскопия (ядерного магнитного резонанса)
- Атомы водорода на углероде, прилегающем к эфиру, обнаруживаются в районе 3,4-4,5 частей на миллион.
- Аналогичные пики в эпоксидах смещены в несколько более высокое поле, чем в других эфирах. Содержание водорода в углеродах и эпоксидах составляет от 2,5 до 3,5 промилле.
Спектр ЯМР 1Н дипропилового эфира показывает три сигнала с триплетом при 3,37 промилле, присвоенным -\(СН_2\)- рядом с эфиром, и двумя другими сигналами в верхнем поле (1,59 и 0,93 промилле). Протоны, расположенные ближе к электрону, отводящему атом кислорода, находятся дальше по полю, что указывает на некоторое ослабление защиты. Протоны в (A) и (C) каждый связаны с двумя эквивалентными (B) протонами. Итак, каждый из этих сигналов выглядит как триплет. Протоны (B), в свою очередь, соединены с набором из двух и трех эквивалентных протонов, и поэтому вы формально ожидаете четверку тройняшек. Однако, поскольку константы связи очень похожи, сигнал отображается в виде секстета.
Спирты и фенолы
Спирты – производные углеводородов, один или несколько атомов водорода в которых заменены на гидроксильную группу -OH. Спирты с одной гидроксильной группой называют одноатомными, с двумя – двухатомными, с тремя трехатомными и т.д. Например:
Спирты с двумя и более гидроксильными группами называют также многоатомными спиртами. Общая формула предельных одноатомных спиртов CnH2n+1OH или CnH2n+2O. Общая формула предельных многоатомных спиртов CnH2n+2Ox , где x – атомность спирта.
Спирты могут быть и ароматическими. Например:
бензиловый спирт
Общая формула таких одноатомных ароматических спиртов CnH2n-6O.
Однако, следует четко понимать, что производные ароматических углеводородов, в которых на гидроксильные группы заменены один или несколько атомов водорода при ароматическом ядре не относятся к спиртам. Их относят к классу фенолы. Например, это данное соединение является спиртом:
А это представляет собой фенол:
Причина, по которой фенолы не относят к спиртам, кроется в их специфических химических свойствах, сильно отличающих их от спиртов. Как легко заметить, однотомные фенолы изомерны одноатомным ароматическим спиртам, т.е. тоже имеют общую молекулярную формулу CnH2n-6O.
Применение простых эфиров
Среда для проведения синтезов
Циклический эфир и диоксан используют в качестве среды для проведения органических синтезов из-за их способности растворять жиры, воск, масла, эфиры, целлюлозу. По химическим свойствам они похожи на простые эфиры, но в отличие от последних могут бесконечно смешиваться с водой и большим количеством органических растворителей.
Экстрагирование
Диэтиловый эфир применяется для экстрагирования веществ. К таким процессам может относиться извлечение спиртов из водных растворов.
Растворение смол
В качестве растворителей используют диэтиловый эфир, тетрагидрофуран, диоксан. Диоксан, в свою очередь, имеет большую, чем диэтиловый спирт, способность растворять, кроме того, гигроскопичен и хорошо смешивается с водой. Также может служить как стабилизатор для хранения 1,1,1-трихлорэтана или транспортировки его в емкостях из алюминия.
Наркоз в медицине
В качестве препарата для наркоза используют диэтиловый эфир, который обладает общеанестезирующими свойствами, влияет на нейронные мембраны, способен обездвижить центральную нервную систему, данная реакция полностью обратима. Препарат для наркоза вскрывают непосредственно перед операцией, после хранения более 6 месяцев проверяют на соответствие установленным требованиям.
Производство лекарств, ароматизаторов
В производстве лекарств и туалетной воды используют метилфениловый эфир (анизол) или этилфениловый эфир (фенетол). Благодаря слабой токсичности данные реагенты практически не раздражают кожу.
Номенклатура и изомерия.
Название сложных эфиров образуется из двух частей: сначала называется радикал, который заместил водород в карбоновой кислоте, а потом называется кислотный остаток кислоты. Поэтому когда перед глазами есть структурная формула сложного эфира, необходимо выделить радикал и фрагмент кислотного остатка, после чего назвать их. На рисунке ниже мы можем выделить остаток уксусной кислоты, имеющий название «ацетат», и радикал «этил». Соединив два слова, получим название сложного эфира – этилацетат.
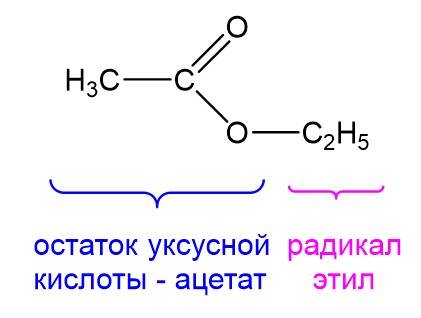
Можно также дать ему более длинное название: этиловый эфир уксусной кислоты. Учитывая, что уксусная кислота – это этановая кислота, то можно дать и еще одно название: этиловый эфир этановой кислоты. Наконец, поскольку соли этановой кислоты помимо ацетатов еще называют этаноатами, получаем четвертое название для нашего сложного эфира: этилэтаноат. Все четыре названия указывают на одно и то же вещество. В ЕГЭ часто специально используют разные названия.
Конечно, радикалы и кислотные остатки в сложных эфирах могут иметь более сложную структуру. Ниже показан такой пример:
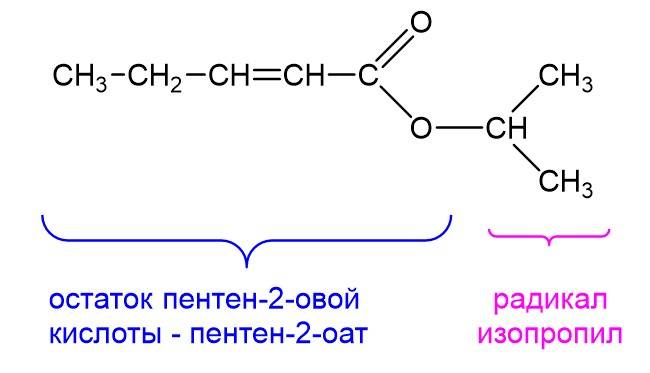
Кислотный остаток здесь образован пентен-2-овой кислотой и называется он пентен-2-оат. А радикал у нас изопропиловый. Соединяем названия радикала и кислотного остатка и получаем: изопропилпентен-2-оат. Такие сложные эфиры вряд ли встретятся в ЕГЭ, разве что в задании на отнесение веществ к классам органических соединений. Но главное понимать принцип того, как составлять их названия.
Понятно, что если радикалы R1 и R2 (см. самый первый рисунок) в сложном эфире достаточно длинные, то они могут давать изомерию углеродного скелета. То есть может метиловый эфир бутановой кислоты и метиловый эфир метилпропановой кислоты.
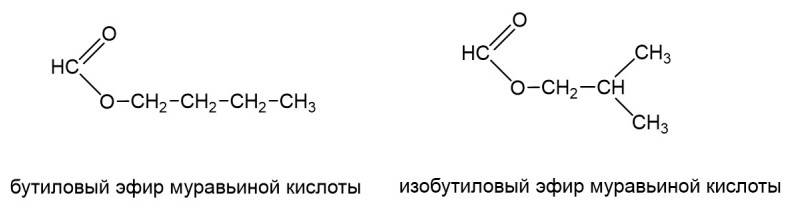
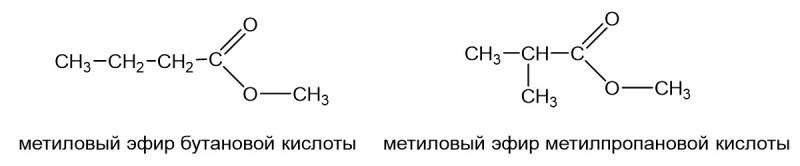 Это изомеры, кислотный остаток в одном случае имеет неразветвленный, а другом разветвленный углеродный скелет. То же самое с радикалом. Может быть бутиловый эфир муравьиной кислоты, а может быть изобутиловый эфир муравьиной кислоты.
Это изомеры, кислотный остаток в одном случае имеет неразветвленный, а другом разветвленный углеродный скелет. То же самое с радикалом. Может быть бутиловый эфир муравьиной кислоты, а может быть изобутиловый эфир муравьиной кислоты.
Также возможна изомерия положения сложноэфирной группы –СO–O–, то есть когда число атомов углерода в сложном эфире постоянно, а сложноэфирная группа смещается по углеродной цепи. Три таких изомера показаны ниже:
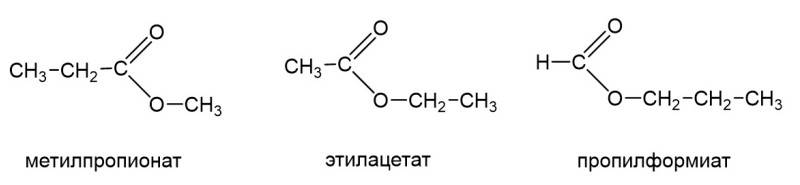
Наконец есть еще важный тип изомерии, знание которого часто проверяется в тестовой части ЕГЭ. Это межклассовая изомерия. У сложных эфиров есть межклассовые изомеры, а именно карбоновые кислоты. «Межклассовый» означает, что сложные эфиры и карбоновые кислоты относятся к разным классам органических соединений, но имеют одинаковую формулу гомологического ряда, а именно CnH2nO2. Ниже в качестве примера показаны этилацетат и бутановая кислота:
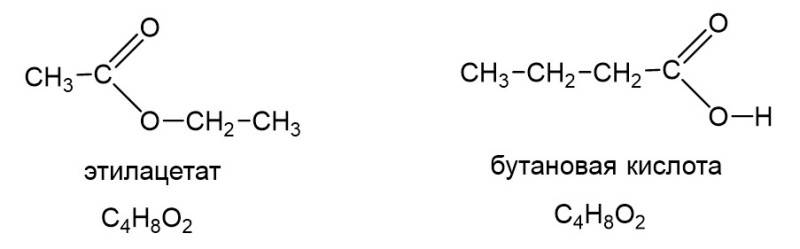
Для сложных эфиров, образованных из непредельной кислоты и/или содержащих непредельный радикал, возможна также изомерия положения кратной связи, а также цис-транс-изомерия.
Химические свойства
- Разрыв связи C-O. Эфиры, как правило, очень неактивны по своей природе.
- Электрофильное Замещение. Алкоксигруппа в эфире активирует ароматическое кольцо в орто- и пара-положениях для электрофильного замещения.
- Галогенирование эфиров.
- Реакция эфиров Фриделя-Крафтса.
Основные свойства
Эфиры являются относительно инертными соединениями; однако при определенных условиях они подвергаются следующим типам реакций :
- Реакции с участием атома кислорода эфира.
- Реакции, включающие расщепление связи C−O в эфире.
- Реакции с участием алкильной группы эфира.
- Реакции электрофильного замещения в ароматических эфирах.
Эфиры — это бесцветные, сладко пахнущие жидкости, которые очень летучи и легко воспламеняются. Из-за Н-связи и гидрофобных алкильных или арильных групп эфиры плохо растворимы в воде.
Эфиры не имеют внутри себя водородных связей. Поэтому их температуры кипения намного ниже, чем у соответствующих спиртов.
Пары диэтилового эфира вызывают потерю сознания при вдыхании и, таким образом, используются в качестве анестезирующего средства.
Эфиры имеют угол связи C – O – C около 110 °C и, следовательно, дипольные моменты двух C – O. Таким образом, простые эфиры полярны, но имеют слабую полярность (для диэтилового эфира = 1,18).
Простые эфиры обладают более низкой реакционной способностью, чем сложные функциональные группы. На них не воздействуют активные металлы, сильные основания, восстановители и окислители. Химические свойства простых эфиров обусловлены наличием алкильной группы, одинокой пары электронов на атоме кислорода и разрывом связи C – O.
Кислотное расщепление
1. Первым шагом в кислотном расщеплении простых эфиров является протонирование кислорода
Нейтральные эфиры, как правило, устойчивы к нуклеофилам в реакциях замещения — это потому, что уходящая группа должна быть RO- , которая является очень сильным основанием.
По этой причине первым шагом в любом расщеплении эфира является протонирование сильной кислотой. Конъюгированная кислота всегда является лучшей уходящей группой. Протонирование эфира допускает потерю ROH в качестве уходящей группы, которая является значительно более слабым основанием, чем RO- . Это подготовит наш следующий шаг — расщепление одной из связей C–O.
Обычной сильной кислотой, которую выбирают, обычно является иодистоводородная кислота (HI). Он не только мощный (pKa -10), иодидный противоион также играет определенную роль.
2. Для метиловых и первичных эфиров второй стадией расщепления эфира является \(SN_2\)
Что происходит дальше после протонирования? Если мы начнем с первичного эфира, такого как диэтиловый эфир, будет хорошая уходящая группа (ROH) на первичном углероде в присутствии приличного нуклеофила (иодид-иона). Так и должно быть — это идеальные условия для реакции \(SN_2\).
Продукт будет ROH и R-I.
Расщепление эфира диэтиловым эфиром hi дает этанол и йодистый этил этанол образует йодистый этил с избытком hi.
Если присутствует избыток (2 эквивалента или более) HI, этот спирт может быть преобразован в алкилйодид посредством двух последующих стадий (протонирование / \(SN_2\)).
3. Для третичных эфиров второй стадией расщепления эфира является \(SN_1\).
Очевидно, что \(SN_2\) здесь не играет роли, так как третичные атомы углерода слишком затруднены для атаки сзади. Однако третичные карбокатионы относительно стабильны — и ионизация (т.е. потеря уходящей группы) оставляет нас со спиртом (R-OH) и третичным карбокатионом, который затем может быть атакован иодид-ионом с образованием R-I.
Радикальное галогенирование
В отсутствие солнечного света алкильная группа эфира подвергается реакции замещения хлором или бромом с образованием α-галогенированных эфиров.
Однако в присутствии солнечного света все атомы водорода в нем замещаются.
Реакции окисления
Автоокисление эфиров
Эфиры, подвергающиеся воздействию воздуха, будут самоокисляться до пероксидов, которые потенциально взрывоопасны. Общая реакция показана ниже.
Например, диизопропиловый эфир будет самоокисляться до продуктов, показанных в реакции ниже.
Традиционная классификация
Специалисты выделяют из общего списка фруктовые эфиры. Этот материал представлен жидкостью с приятным ароматом. Одна молекула вмещает в себе не больше восьми атомов углерода. Добывают их из карбоновых кислот и спиртов. Эфиры с нежным цветочным запахом получают с помощью ароматического этила. Воски представлены твёрдыми компонентами, в состав которых может входить от 10 до 50 атомов С.
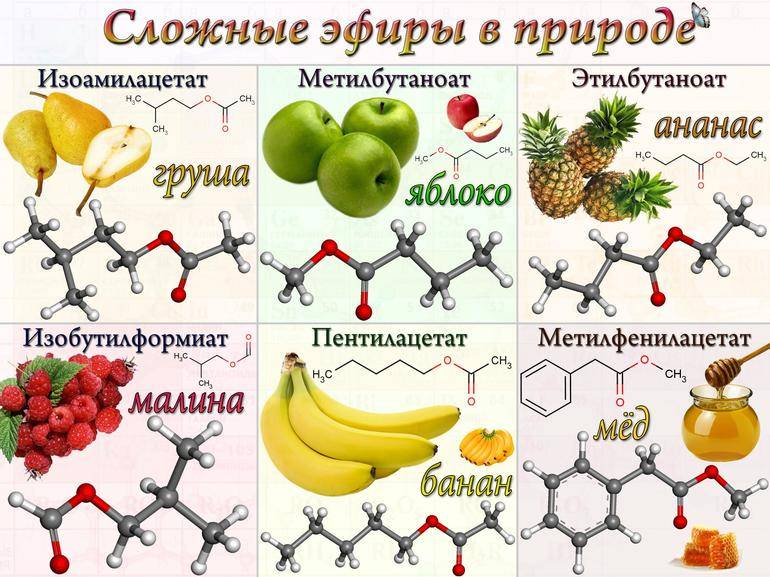
Немного иная ситуация с жирами. В их состав может входить максимум двадцать атомов. Стоит отметить, что консистенция жиров может быть жидкой или твёрдой. По своим физическим свойствам сложные эфиры минеральных кислот могут быть маслянистыми жидкостями. В некоторых случаях встречаются твёрдые вещества.
Свойства
Химические свойства сложных эфиров обусловлены функциональной группой -COOH. Основные свойства сложных эфиров описаны в таблице.
Реакция | Описание | Уравнение |
Гидролиз | При нагревании в воде разлагаются на кислоту и спирт. Под действием раствора щёлочи образуются соль и спирт |
|
Галогенирование | Реакция возможна при наличии кратных связей | CH2=CH-C(O)-O-CH3 + Br2 → Br-CH2-C(Br)H-C(O)-O-CH3 |
Замещение | Радикалы замещаются остатками спиртов и аминогруппой |
|
Сложные эфиры используются в косметологии, медицине, пищевой промышленности в качестве ароматизаторов, растворителей, наполнителей.
Что мы узнали?
Из темы урока химии 10 класса узнали, что такое сложные эфиры. Это соединения, включающие два радикала и карбоксильную группу. В зависимости от происхождения могут содержать остатки минеральных или карбоновых кислот. Сложные эфиры карбоновых кислот делятся на три группы: жиры, воски, фруктовые эфиры. Это плохо растворимые в воде вещества с небольшой плотностью и приятным ароматом. Сложные эфиры реагируют со щелочами, водой, галогенами, спиртами и аммиаком.
/5
Вопрос 1 из 5
Экспертная оценка
Номенклатура получения сложных эфиров создаётся традиционным образом: первым делом указывается обширная группа R, которая присоединена к кислоте. Только после этого прописывается название кислоты с обязательной частицей «АТ». В формулах фрагменты молекул и соответствующие им названия обозначаются одним оттенком, чтобы в дальнейшем не запутаться.
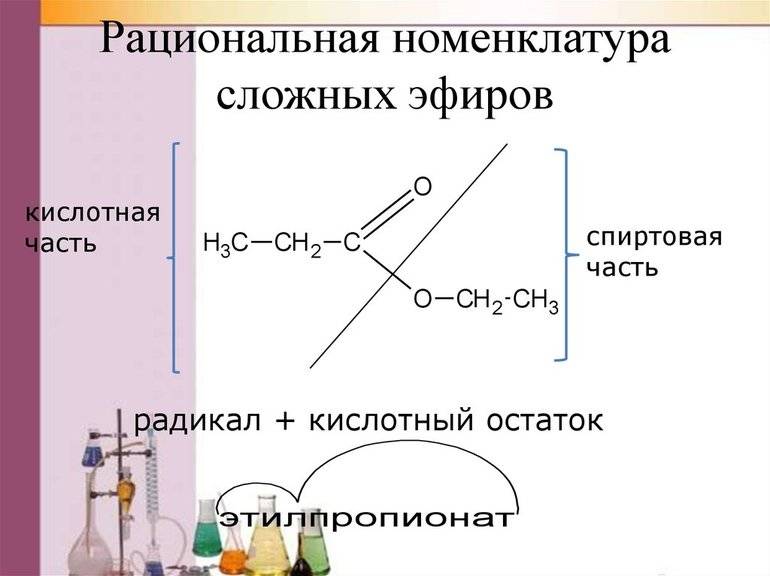
СЭ эксперты рассматривают как продукты специфической реакции между этилом и кислотой. Например, бутилпропионат можно расценивать как результат взаимодействия классического бутанола и пропионовой кислоты. В каждом случае действуют свои нюансы уравнения характеристик.
Большое количество СЭ представлено в виде прочных кристаллов либо жидкости с тонким приятным запахом. Чаще всего температура их закипания гораздо ниже, чем у похожих по значению небольших молекулярных масс карбоновых веществ. За счёт этого происходит уменьшение классических взаимодействий. Такой эффект также можно объяснить тем, что между соседними молекулами отсутствуют распространённые водородные связи.
Физические и химические свойства зависят от базовых особенностей строения отдельных мелких частиц. В главной роли выступает карбоновая кислота и спирт, из которых образованы молекулы.
Именно поэтому эксперты делят сложные эфиры на три базовые категории:
- Воски.
- Жиры.
- Эфиры различных фруктов.
Список эфирных ароматизаторов
Многие сложные эфиры имеют характерный фруктовый запах, и многие из них естественным образом содержатся в эфирных маслах растений. Это также привело к их обычному использованию в искусственных ароматизаторах и ароматизаторах, имитирующих эти запахи.
| Имя Эстер | Структура | Запах или появление |
|---|---|---|
| Аллил гексаноат | ананас | |
| Бензилацетат | груша , клубника , жасмин | |
| Борнилацетат | сосна | |
| Бутил ацетат | яблоко , мед | |
| Бутилбутират | ананас | |
| Бутилпропаноат | грушевые капли | |
| Ацетат этила | жидкость для снятия лака , модельная краска , авиамодельный клей | |
| Этилбензоат | сладкий , грушевый , фруктовый , лекарственный, вишневый , виноградный | |
| Этилбутират | банан , ананас , клубника | |
| Этил гексаноат | ананас , восково-зеленый банан | |
| Этилциннамат | корица | |
| Этилформиат | лимон , ром , клубника | |
| Этил гептаноат | абрикос , вишня , виноград , малина | |
| Этил изовалерат | яблоко | |
| Этил лактат | сливочное масло , сливки | |
| Этилнонаноат | виноград | |
| Этил пентаноат | яблоко | |
| Геранил ацетат | герань | |
| Геранил бутират | вишня | |
| Геранил пентаноат | яблоко | |
| Изобутилацетат | вишня , малина , клубника | |
| Изобутилформиат | малина | |
| Изоамилацетат | груша , банан (ароматизатор в грушевых каплях ) | |
| Изопропилацетат | фруктовый | |
| Линалилацетат | лаванда , шалфей | |
| Линалил бутират | персик | |
| Линалил формиат | яблоко , персик | |
| Метилацетат | клей | |
| Метилантранилат | виноград , жасмин | |
| Метилбензоат | фруктовый, иланг-иланг , фейхоа | |
| Метилбутират (метилбутаноат) | ананас , яблоко , клубника | |
| Метил циннамат | клубника | |
| Метилпентаноат ( метилвалерат ) | цветочный | |
| Метил фенилацетат | мед | |
| Метилсалицилат ( масло грушанки ) | Современное корневое пиво , грушанка , мази Гермолен и Ралгекс (Великобритания) | |
| Нонил каприлат | оранжевый | |
| Октилацетат | фруктово- апельсиновый | |
| Октилбутират | пастернак | |
| Амилацетат (пентилацетат) | яблоко , банан | |
| Пентилбутират (амилбутират) | абрикос , груша , ананас | |
| Пентил гексаноат (амиловый капроат) | яблоко , ананас | |
| Пентилпентаноат ( амилвалерат ) | яблоко | |
| Пропилацетат | груша | |
| Пропил гексаноат | ежевика , ананас , сыр , вино | |
| Пропил изобутират | ром | |
| Терпенилбутират | вишня |
Реакции
Сложные эфиры реагируют с нуклеофилами у карбонильного углерода. Карбонил слабо электрофилен, но подвергается атаке сильных нуклеофилов (аминов, алкоксидов, источников гидридов, литийорганических соединений и т. Д.). Связи С – Н, прилегающие к карбонилу, слабо кислые, но подвергаются депротонированию сильными основаниями. Этот процесс обычно инициирует реакции конденсации. Карбонильный кислород в сложных эфирах является слабоосновным, в меньшей степени, чем карбонильный кислород в амидах из-за резонансной передачи электронной пары из азота в амидах, но образует аддукты .
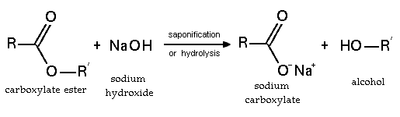
Гидролиз и омыление
Этерификация — обратимая реакция. Сложные эфиры подвергаются гидролизу в кислотных и основных условиях. В кислых условиях реакция является обратной реакцией этерификации Фишера . В основных условиях гидроксид действует как нуклеофил, а алкоксид — уходящая группа. Эта реакция — омыление — лежит в основе мыловарения.
Алкоксидная группа также может быть замещена более сильными нуклеофилами, такими как аммиак или первичные или вторичные амины, с образованием амидов : (реакция аммонолиза)
- RCO 2 R ‘+ NH 2 R ″ → RCONHR ″ + R′OH
Эта реакция обычно необратима. Вместо аминов можно использовать гидразины и гидроксиламин. Сложные эфиры могут быть превращены в изоцианаты через промежуточные гидроксамовые кислоты в перегруппировке Лоссена .
Источники углеродных нуклеофилов, например реактивы Гриньяра и литийорганические соединения, легко присоединяются к карбонилу.
Сокращение
По сравнению с кетонами и альдегидами сложные эфиры . Введение каталитического гидрирования в начале 20-го века было прорывом; сложные эфиры жирных кислот гидрируются до жирных спиртов .
- RCO 2 R ‘+ 2 H 2 → RCH 2 OH + R’OH
Типичный катализатор — хромит меди . До разработки каталитического гидрирования сложные эфиры восстанавливали в больших масштабах с использованием восстановления Буво-Блана . В этом методе, который в значительной степени устарел, используется натрий в присутствии источников протонов.
Литийалюминийгидрид используется для восстановления сложных эфиров до двух первичных спиртов, особенно для тонкого химического синтеза . Соответствующий реагент борогидрид натрия медленен в этой реакции. DIBAH восстанавливает сложные эфиры до альдегидов.
Прямое восстановление с получением соответствующего эфира затруднено, поскольку промежуточный полуацеталь имеет тенденцию к разложению с образованием спирта и альдегида (который быстро восстанавливается с образованием второго спирта). Реакция может быть осуществлена с использованием триэтилсилана с различными кислотами Льюиса.
Конденсация Клайзена и родственные реакции
Что касается альдегидов , атомы водорода на углероде, примыкающем («α к») к карбоксильной группе в сложных эфирах, являются достаточно кислыми, чтобы подвергаться депротонированию, что, в свою очередь, приводит к множеству полезных реакций. Для депротонирования требуются относительно сильные основания, такие как алкоксиды . Депротонирование дает нуклеофильный енолят , который может далее реагировать, например, конденсация Клайзена и ее внутримолекулярный эквивалент, конденсация Дикмана . Это превращение используют в синтезе сложного эфира малоновой кислоты , где сложный диэфир малоновой кислоты реагирует с электрофилом (например, алкилгалогенидом ) и впоследствии декарбоксилируется. Другой вариант — алкилирование Фратера-Зеебаха .
Другие реакции
- Фениловые эфиры реагируют с гидроксиарилкетонами в перегруппировке Фриса .
- Определенные сложные эфиры функционализированы α-гидроксильной группой в перегруппировке Чана .
- Сложные эфиры с β-атомами водорода могут быть превращены в алкены при пиролизе сложных эфиров .
- Прямое преобразование сложных эфиров в нитрилы .
Защита групп
Как класс, сложные эфиры служат защитными группами для карбоновых кислот . Защита карбоновой кислоты полезна при синтезе пептидов, чтобы предотвратить самореакцию бифункциональных аминокислот . Метиловые и этиловые эфиры обычно доступны для многих аминокислот; т — бутиловый эфир имеет тенденцию быть более дорогими. Однако сложные трет- бутиловые эфиры особенно полезны, потому что в сильно кислых условиях сложные трет- бутиловые эфиры подвергаются элиминированию с образованием карбоновой кислоты и изобутилена , что упрощает обработку.
Номенклатура
Рекомендации ИЮПАК позволяют при присвоении названий простым эфирам вида R-O-R’ использовать разные типы номенклатуры:
- заместительную — когда группа R’-O- считается заместителем в родоначальном углеводороде RH;
- радикало-функциональную — называя функцию словом «эфир» (название «оксид» не рекомендуется) и перечисляя названия радикалов R и R’ в виде приставок;
- умножительную (если R и R’ циклические);
- заменительную;
- номенклатуру фанов.
Заместительная номенклатура является предпочтительной. В этом случае один из радикалов (R) выполняет роль родоначального углеводорода (RH) и получает название, соответствующее этому углеводороду. Группа R’O- считается заместителем, и её название образуется слиянием названия радикала R’ и приставки окси, например:
- CH3CH2CH2CH2CH2O- — пентилокси-.
В нескольких случаях за заместителем R’O- сохранено традиционное название:
- CH3O- — метокси-; CH3CH2O- — этокси-; CH3CH2CH2O- — пропокси-; CH3CH2CH2CH2O- — бутокси-; C6H5O- — фенокси-; (CH3)3CO- — трет-бутокси-; (CH3)2CHO- — изопропокси-.
В таком случае полные названия простых эфиров выглядят следующим образом:
- CH3OCH3 — метоксиметан;
- CH3CH2OCH3 — метоксиэтан;
- PhOCH3 — метоксибензол (также: анизол).
В радикало-функциональной номенклатуре названия заместителей перед словом «эфир» перечисляются в алфавитном порядке:
- CH3OCH3 — диметиловый эфир;
- CH3CH2OCH3 — метилэтиловый эфир;
- PhOCH3 — метилфениловый эфир.
Заменительную номенклатуру удобно использовать в случае полиэфиров. В этом случае соединение называется как углеводород, а место, где углеродный атом формально заменён кислородом, называют в виде приставки «окса»-:
- CH3OCH2CH2OCH2CH2OCH2CH2OCH3 — 2,5,8,11-тетраоксадодекан;
- (по заместительной номенклатуре: 1-метокси-2-этан).
В редких случаях, когда оба заместителя в простом эфире являются циклическими, можно использовать умножительную номенклатуру:
- PhOPh — 1,1′-оксидибензол.
Химическое поведение и свойства
Простые эфиры можно отнести к малореакционноспособной группе органических соединений, так как они проявляются слабоосновные свойства. Расщепляются только некоторые вещества и только при нагревании.
Окисление
Реакция окисления проходит с образованием перекисных соединений, что называется автоокислением. При хранении способны окислятся при помощи кислорода и образовывать перекиси, а именно неустойчивые гидропероксиды и пероксиды
При перегонке простых эфиров особенно важно тщательно отчистить их от перекисей, так как они потенциально способны вызвать взрыв
Разложение
Расщепляются при температуре до 120-150 градусов по Цельсию с концентрированными бромоводородом или ионоводородом 48% концентрацией.
Эфиры, которые содержат третичную алкильную группу, расщепляются легче.
Способны образовывать карбокатион, если есть третичная алкильная, бензильная или аллильная группа. Реакция происходит по Sn1-механизму в качестве интермедиата. Данные реакции протекают в мягких условиях, кислотным агентом может выступать трифторуксульная кислота.
Синтез
Синтез простых эфиров протекает по реакции Вильямсона. Суть реакции в том, что алкилгалогениды взаимодействуют с алкоголятами щелочных металлов.
Таким образом получаются симметричные и ассиметричные эфиры.
Реакция Вильямсона получила второе рождение после того, как открыли класс краун-эфиров. В них первая цифра означает размер цикла, вторая – число атомов кислорода, участвующих в цикле.
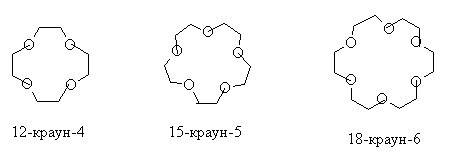
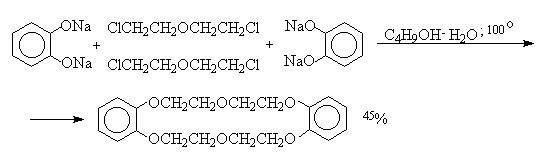
В 1967 году благодаря реакции Вильямсона был получен первый краун-полиэфир, который назывался дибензо-18-краун-6. Реакция происходила между хлорэтиловым эфиром и динатриевой солью пирокатехина.
Восстановление
Реакция восстановления протекает согласно уравнению:
Для результата требуются жесткие условия. Труднее всего реакция протекает с дифениловым эфиром или его производными.
Возможность комбинирования
В сложных эфирах, напротив, присутствуют два или более различных компонента, которые могут быть объединены вместе. Это позволяет создавать более сложные и разнообразные соединения.
Комбинирование компонентов в сложных эфирах происходит за счет химической реакции, в результате которой образуется новое вещество. Это добавляет сложности в процессе синтеза и исследования сложных эфиров, но также предоставляет возможность для получения новых соединений с уникальными свойствами и своеобразными приложениями.
Например: одним из наиболее известных сложных эфиров является эфир метила. Он состоит из метильного радикала (CH3) и остатка метановой кислоты (CH3COO-). Такое сочетание компонентов позволяет эфиру метила использоваться в различных отраслях промышленности, таких как производство растворителей, пластиков и лаков.
Возможность комбинирования различных компонентов в сложных эфирах предоставляет исследователям и производителям широкие возможности для создания новых веществ с улучшенными свойствами и расширением сферы их применения.
Сложные эфиры: особенности и преимущества
Одним из основных преимуществ сложных эфиров является их высокая стабильность и стойкость к окружающей среде. Благодаря этому, они могут использоваться в условиях высоких температур, влажности, воздействия агрессивных веществ и других экстремальных условиях.
Кроме того, сложные эфиры обладают высокой растворимостью в различных органических и неорганических растворителях, что делает их универсальным ингредиентом для создания различных продуктов. Они могут использоваться как растворители для других веществ или как добавки, улучшающие технические и физико-химические свойства материалов.
Также стоит отметить, что сложные эфиры обладают высокой биологической активностью и могут использоваться в фармацевтической промышленности для создания лекарственных препаратов. Они могут обладать антимикробными, противовоспалительными и антиоксидантными свойствами, что делает их незаменимыми в лечении различных заболеваний.