Практическое применение знаний о различиях молекул воды и пара
Понимание различий между молекулами воды и пара имеет непосредственное практическое применение в различных отраслях науки и технологии. Ниже приведены некоторые области, где эти знания играют важную роль:
1. Разработка процессов и оборудования для кондиционирования воздуха. Понимание различий между молекулами воды и пара позволяет инженерам разрабатывать системы кондиционирования воздуха более эффективно. Это связано с тем, что молекулы воды имеют свойства адсорбции и десорбции, что позволяет использовать специальные материалы для удаления влаги из воздуха.
2. Энергетика и энергосбережение. Знание различий между молекулами воды и пара играет важную роль в энергетической отрасли. Например, давление пара является ключевым параметром в процессе генерации электроэнергии в турбинах паровых электростанций. Также, энергосберегающие технологии, такие как сжатие пара в цикле, основаны на понимании различных свойств воды и пара.
3. Технология пищевой и химической промышленности. Различия между молекулами воды и пара важны для контроля и хранения пищевых и химических продуктов. Например, эвапорация паром используется для концентрирования растворов, а кристаллизация парообразной воды часто используется в процессе изготовления подсластителей.
4. Медицина и фармакология. Знание различий между молекулами воды и пара играет важную роль в медицине и фармакологии. Например, понимание свойств пара помогает в разработке методов стерилизации медицинского оборудования и материалов. Также, процессы пароочистки часто используются для очистки фармацевтических продуктов от загрязнений.
В целом, понимание различий между молекулами воды и пара имеет широкий спектр применений и играет важную роль в различных отраслях науки и технологии. Это позволяет улучшать существующие технологии, создавать новые инновационные процессы и материалы, а также повышать эффективность и экономичность различных систем и устройств.
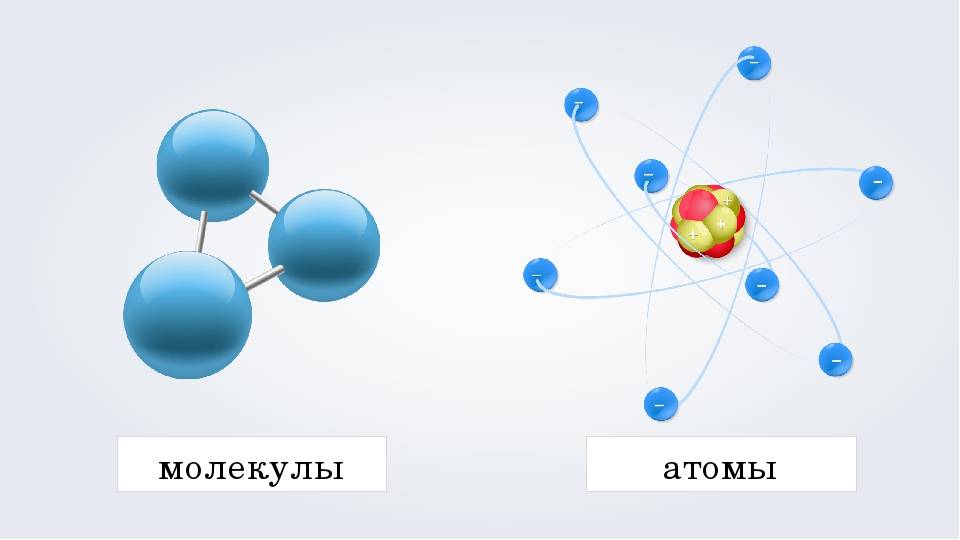
Физические свойства молекул воды
Молекулы воды обладают рядом уникальных физических свойств, которые отличают их от молекул пара.
1. Полярность: Молекулы воды являются полярными, что означает, что у них есть неравномерное распределение электронной плотности и наличие положительного и отрицательного заряда. Это делает их способными к образованию водородных связей и обладанию высокой адгезией и поверхностным натяжением.
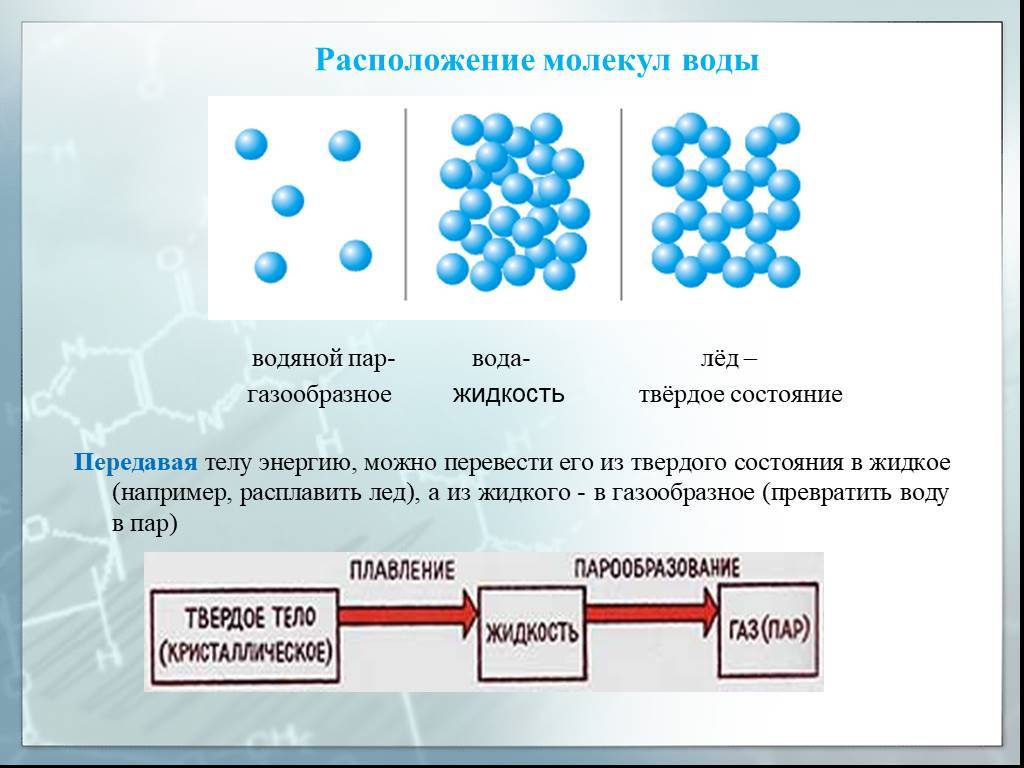
2. Конденсация и испарение: Вода может существовать в трех фазах – твердой, жидкой и газообразной. При повышении температуры молекулы воды получают энергию и переходят из жидкого состояния в газообразное, что называется испарением. При охлаждении газообразной воды энергия уходит, и она конденсируется обратно в жидкую форму.
3. Теплоемкость: Молекулы воды обладают высокой теплоемкостью, что делает их способными к поглощению и сохранению большого количества тепла. Это является причиной того, что мы можем использовать воду для охлаждения и нагревания различных систем и процессов.
4. Высокая плотность: Вода имеет наибольшую плотность при температуре +4 °C, что означает, что ее молекулы упаковываются плотнее и занимают меньше объема. Это приводит к тому, что лед, образующийся при замерзании жидкой воды, плавает на поверхности.
5. Капиллярность: Молекулы воды обладают способностью подниматься по узким каналам, протекать по капиллярам и поглощаться различными материалами. Это объясняет такие явления, как подъем воды в растениях и возможность поглощения воды губками и тканями.
Изменение состояния молекулы пара
Изменение состояния молекулы пара происходит благодаря воздействию энергии тепла. При повышении температуры жидкой воды, ее молекулы начинают двигаться все быстрее и активнее. При этом, часть молекул приобретает достаточный уровень энергии для преодоления межмолекулярных сил притяжения и выходит в газообразное состояние.
Важно отметить, что не все молекулы одновременно переходят в состояние пара. Переход происходит ступенчато, по мере накопления энергии в системе
Поэтому в жидкости всегда присутствует как жидкая вода, так и пар. При наличии открытой поверхности, пара может улетучиваться в окружающую среду.
Молекулы пара также отличаются от молекул воды благодаря своему более высокому среднеквадратичному движению. В газообразном состоянии молекулы пара перемещаются на большие расстояния и сталкиваются друг с другом. При этом, столкновения молекул пара являются упругими.
Молекулы-пары восстановят свое движение только при их снижении температуры. При этом они могут снова образовывать жидкую воду путем конденсации и схлопывания.
Из чего состоит вода
При обычных условиях вода выглядит как прозрачная жидкость. У нее отсутствуют вкус и запах. При небольшой толщине слоя не наблюдается даже цвета.
Вода является отличным растворителем. В природе в ней постоянно находятся растворенные газы и соли. При соединении атомов кислорода с водородом получается молекула воды. Поскольку более сильными являются водородные соединения, то, когда происходит их разрыв, они прикрепляются к иным веществам, помогая тем растворяться.
Из-за своего малого размера каждую молекулу растворенного вещества окружают очень много молекул воды. Благодаря этому в ней присутствуют отрицательные и положительные ионы.
Чистая вода является еще и хорошим изолятором с концентрацией протонов и гидроксильных ионов в количестве 10-7 моль/л, это позволяет ей проводить электричество. Именно по ее электропроводности можно оценивать чистоту жидкости.
При взаимодействии с другими веществами состав воды не изменяется, что играет особую роль в жизни любого живого организма
Ведь очень важно, чтобы жидкостные растворы, через которые в организм поступают полезные вещества, не изменялись
Кроме того, вода хорошо поглощает инфракрасное и микроволновое излучение, а также способна хранить в себе память о веществах, которые были в ней растворены.
Элементы
Проходя гидрологический цикл: испарение, конденсацию и выпадение в виде осадков вода может дополняться разными химическими элементами, которые можно разделить на 6 категорий. Рассмотрим информацию в таблице № 1.
Таблица № 1 «Элементы, которые могут входить в состав воды».
| Ионы | Na, K, Mg, Ca, анионы: Cl, HCO3 и SO4. Эти компоненты находятся в воде в наибольшем, по сравнению с другими, количестве. |
| Растворенные газы | Кислород, азот, сероводород, углекислый газ и прочие. Количество каждого газа в воде напрямую зависит от ее температуры. |
| Биогенные элементы | Главными из них являются фосфор и азот, которые поступают в жидкость из осадков |
| Микроэлементы | Их насчитывается около 30 видов: бром, селен, медь, цинк и т. д. Показатели их в составе воды очень малы и колеблются от 0,1 до микрограмма на 1 литр. |
| Органические вещества | Спирты, углеводы, альдегиды, фенолы, пептиды и прочее. |
| Токсины | Тяжелые металлы и продукты нефтепереработки. |
В настоящий момент доступны специальные методы очистки, которые эффективно борются с вредными химическими соединениями.
Вода также может содержать в себе магний и катионы кальция. В зависимости от этого ее подразделяют на мягкую и жесткую.
По изотопам водорода в молекуле воды можно говорить о легкой воде, тяжелой и сверхтяжелой воде.
Main Difference Between Water and Steam
- Water is a liquid, but steam is water in a gaseous state.
- The temperature of the water remains between 0 degrees to 99 degrees. On the other hand, the temperature of the steam is 100 degrees.
- Water is visible to the naked eye. In small quantities, water is colorless, but it has a blue color. The naked eye can not see steam in its most natural and purest state. Most people identify steam coming out from boiling water as visible and colored white.
- The molecules of water are tighter and less fast compared to steam. On the contrary, the steam molecules are looser and faster than water.
- Water doesn’t have any burning risk, rather, it is used to extinguish fires, while steam can produce severe burning.
Фазовые переходы
Испарение — это фазовый переход, при котором молекулы воды преобразуются из жидкого состояния в пар. В процессе испарения, энергия переходит от молекул кинетической энергии воды, что вызывает разделение молекул и образование пара.
Конденсация — это фазовый переход, при котором молекулы пара преобразуются в жидкое состояние. В процессе конденсации, кинетическая энергия молекул пара сокращается и преобразуется в потенциальную энергию, что вызывает скопление молекул и образование жидкости.
Оба фазовых перехода — испарение и конденсация — зависят от температуры и давления в окружающей среде. Повышение температуры или снижение давления способствуют увеличению скорости испарения и снижению скорости конденсации, в то время как понижение температуры или повышение давления способствуют увеличению скорости конденсации и снижению скорости испарения.
Физические свойства воды и водяного пара: в чем различие?
Одним из основных различий между водой и водяным паром является плотность. Плотность воды составляет около 1000 килограммов на кубический метр, тогда как плотность водяного пара гораздо меньше и составляет около 0,6 килограмма на кубический метр. Это связано с тем, что водяной пар состоит из отдельных молекул, которые имеют большую скорость движения и располагаются на большом расстоянии друг от друга.
Другое отличие между водой и водяным паром — это температура кипения. Вода кипит при температуре 100 градусов Цельсия при атмосферном давлении, в то время как водяной пар кипит при высоких температурах, которые зависят от давления. Например, при нормальных условиях атмосферного давления водяной пар кипит при температуре около 100 градусов Цельсия, но при снижении давления температура кипения водяного пара также снижается.
Еще одним различием между водой и водяным паром является вязкость. Вода обладает высокой вязкостью, что означает, что она имеет сложную структуру и проявляет сопротивление при сдвиге. Наоборот, водяной пар имеет низкую вязкость, что означает, что он легко движется и не оказывает сопротивления.
Также водяной пар и вода имеют разное давление. Вода обычно имеет нормальное атмосферное давление, тогда как водяной пар имеет давление, зависящее от температуры и объема воды.
| Свойство | Вода | Водяной пар |
|---|---|---|
| Плотность | 1000 кг/м³ | 0,6 кг/м³ |
| Температура кипения при атмосферном давлении | 100°C | 100°C (при нормальном давлении) |
| Вязкость | Высокая | Низкая |
| Давление | Нормальное атмосферное давление | Зависит от температуры и объема |
Молекулярная структура воды
Длительный период времени ученые описывали молекулярную структуру воды простым соединением без возможности комплексных взаимодействий с другими веществами. И наконец, вода была поставлена в один ряд со сложными веществами химиком Лавуазье в 1783 г.
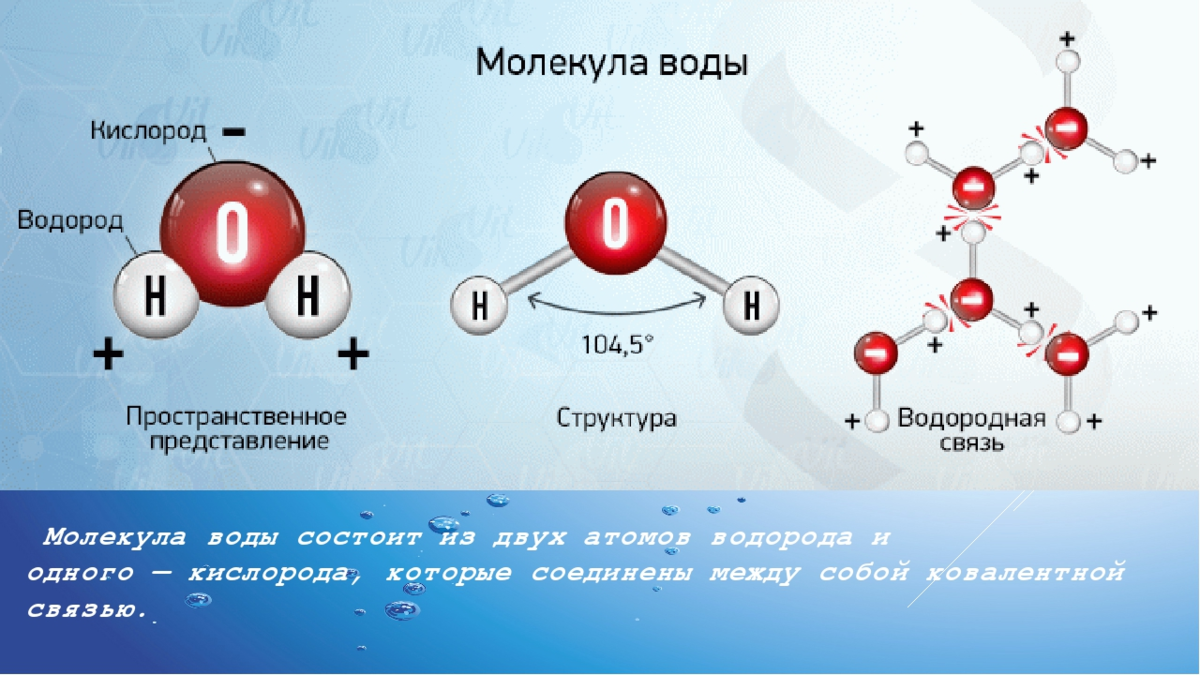
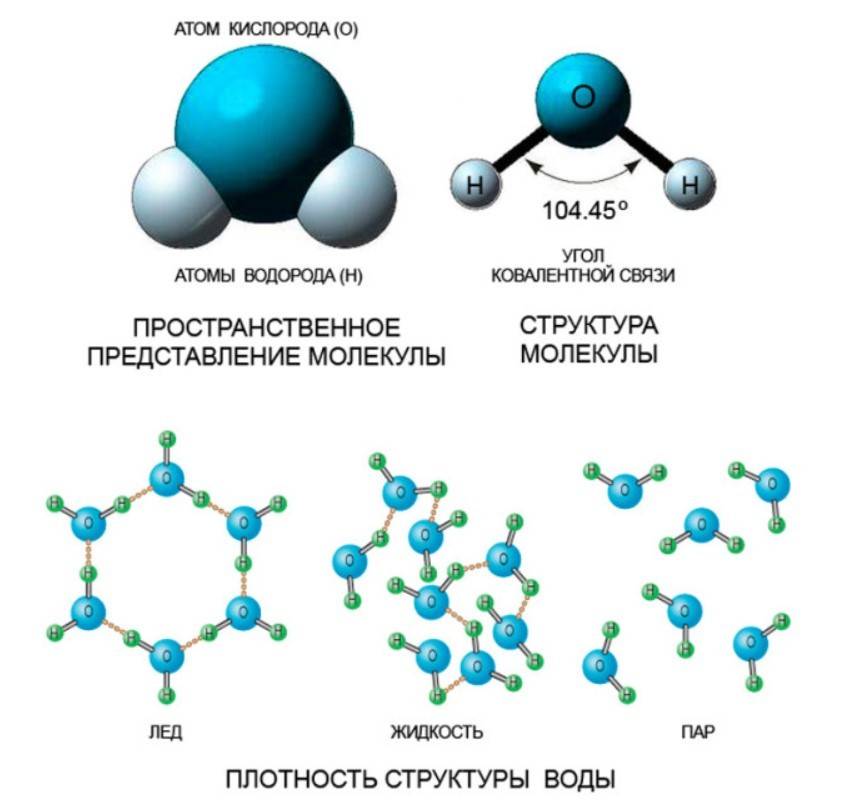
Молекулярный состав воды определяется тремя атомами; из них два атома водорода и один атом кислорода, имеющие между собой ковалентную связь.
Химическая формула воды: H₂O.
Основные характеристики ковалентной связи выражены такими понятиями, как направленность, насыщаемость, полярность, поляризуемость. Эти параметры являются химическими и физическими свойствами соединений.
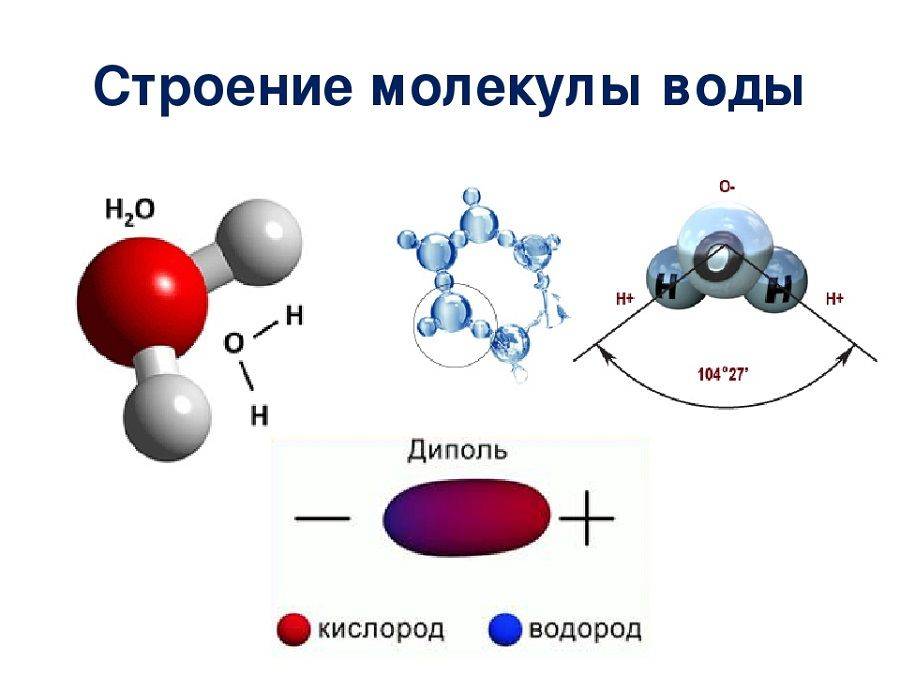
Форма молекулы воды похожа на равнобедренный треугольник с двумя атомами водорода в основании (по одному атому в каждом углу). Между атомами кислорода и водорода наблюдается полярная связь, которая объясняется свойством кислорода сильнее (по сравнению с водородом) притягивать электроны.
Молекулярная структура воды
Межъядерные расстояния О—Н близки к 0,1 нм, расстояние между ядрами атомов водорода равно 0,15 нм, угол между связями Н—О—Н равен 104,5°.
Молекулярная структура воды подразумевает наличие двух положительно и двух отрицательно заряженных полюса, этим можно объяснить ее проявление в качестве диполя (в большинстве случаев).
Показатели эффективных зарядов на атомах равны ±0,17 от заряда электрона.
Наличие водородной связи наделяет воду в жидком состоянии свойством осуществлять ассоциацию молекул (соединять их в сложные вещества).
Особое внимание водородная связь заслужила благодаря своей не сильно высокой устойчивости. Кроме того, водородная связь оказывает прямое влияние на способность воды растворять вещества, так как конкретно от соединения водородных связей с растворителем зависят характеристики растворимости
Именно взаимодействием водородных связей с содержащими ОН-группы веществами (сахар, глюкоза, спирт, карбоновые кислоты) можно объяснить их отличный уровень растворения в воде
Кроме того, водородная связь оказывает прямое влияние на способность воды растворять вещества, так как конкретно от соединения водородных связей с растворителем зависят характеристики растворимости. Именно взаимодействием водородных связей с содержащими ОН-группы веществами (сахар, глюкоза, спирт, карбоновые кислоты) можно объяснить их отличный уровень растворения в воде.
Димер — это водородная связь двух молекул H2O.
Каждая молекула имеет способность формировать четыре водородные связи: две между неподеленными парами ее атома кислорода и атомами водорода соседних молекул и еще две – между атомами водорода и атомами кислорода двух соседних молекул.
Границы энергии водородной связи могут варьироваться от 17 до 33 кДж/моль.
Молекулярная структура воды
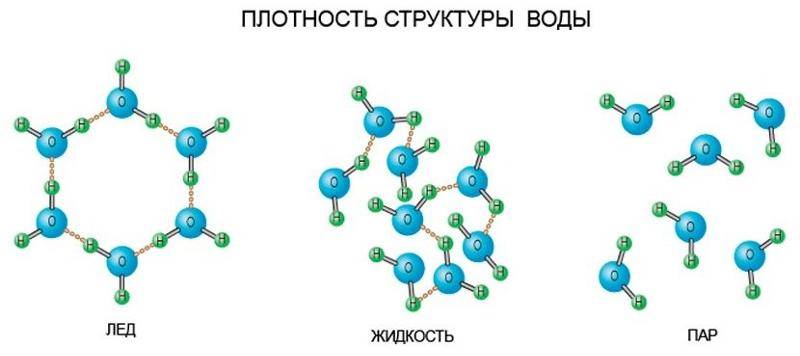
Различают несколько состояний воды:
Жидкое. Основное состояние в нормальных условиях.
Твердое. Это лед, а также в форме кристаллов – иней или снег.
Газообразное — водяной пар.
Три исследования, которые помогут остановить старение
Такой простой элемент как вода всегда считался жизненно важным и необходимым. Но вместе с тем, то количество мифов о воде, научных фактов и мнений, которые ежедневно навязывают, а потом опровергают, побуждает искать ответы на вопросы. Чтобы помочь вам, мы с командой подготовили вебинар и подарок: 3 уникальных материала, основанные на опыте наших экспертов о продлении молодости с помощью воды. После прохождения нашего бесплатного вебинара вы узнаете:
практикующий врач терапевт-диетолог, натуропат
Сразу после регистрации вы получите подборку исследований:
Старение: остановить нельзя смириться К каким выводам пришли ученые 21 века, изучая воду и ее способность продлевать молодость
На самом деле, мы ничего не знаем о воде Важная информация для продления молодости, которую нам могли рассказать еще в школе
Водородная вода – самое мощное природное средство для продления молодости Почему вода, обогащенная водородом, считается самым эффективным, безопасным и доступным способом продлить молодость
Узнайте, как вода может заботиться о вашем здоровье, молодости и красоте на бесплатном вебинаре врача-диетолога Артёма Хачатряна!
Выделяют также и переходные состояния воды, которые обусловлены ее замерзанием или испарением.
Удивительно и в то же время вполне естественно, что можно наблюдать соседство и даже взаимодействие воды, одновременно находящейся в разных агрегатных состояниях: озера с ледниками, айсберги в океане, облака на небе, состоящие из водяного пара и капель жидкой воды.
Ознакомимся подробнее с особенностями каждого агрегатного состояния воды.
Перенасыщенный пар
Рассмотрим ситуацию, когда пары жидкости заключены в сосуде определенного объема. Понижение их температуры приведет к состоянию насыщения с последующей конденсацией. Капли жидкости будут оседать на стенках сосуда.
В то же время нужно помнить, что жидкость образуется только там, где есть так называемые центры конденсации. Это различные частички пыли, ионы, шипики на поверхности тел и т.д. В случае их отсутствия формирования капель не происходит, а образуется перенасыщенный пар. Его отличие в том, что оказываемое давление на стенки сосуда выше давления насыщенного пара, поскольку он имеет большую плотность.
Такое состояние называется метастабильным. Оно распространено в природе и часто используется в технике и науке. Для атмосферы характерно насыщение мельчайшими крупинками морской соли, которые являются ядрами для конденсации.
Определенная роль отводится также дыму.
Способы создания
Создать такое вещество, как пересыщенный пар, можно двумя способами:
- Увеличить давление пара при постоянной температуре.
- Охладить насыщенный пар (переохлажденный).
Для перенасыщенного пара характерна способность пребывать в таком состоянии долго, до тех пор, пока произойдет изменение температуры, давления. Тогда происходит конденсация, и пар переходит в состояние перенасыщенного. Таким образом, процесс переходит в стадию динамического равновесия.
Для визуализации движений частиц существует камера Вильсона. Принцип ее работы следующий: неперенасыщенный пар быстро увеличивает свой объем, поэтому не успевает отдать тепло. Резко охлаждается. Тогда в камеру направляется частица с зарядом, суть «работы» которой сводится к ионизации молекул. Ионы в данной ситуации являются зародышами конденсации. Вокруг них образуются водяные капли, они растут, пока не становятся зрительно заметными. Примечательно, что капли распределяются по траектории запущенной частицы, они хорошо заметны и могут быть зафиксированы.
Далее происходит следующий запуск камеры Вильсона, в котором идет образование пересыщенного пара. Этому способствует повышение давления, например, путем сжимания поршнем.
Water vs Steam
The difference between water and steam is that water is in the liquid form, on the other hand, steam refers to water in the gaseous form.
Water can be seen by the naked eye easily, and it has visibility. But steam is invisible or colorless in its purest and most natural state (without adding condensed water to it).
Water is a substance made of chemical elements like oxygen and hydrogen.
It is an odorless and tasteless liquid (at room temperature) and is considered one of the most essential and plentiful compounds.
It is colorless in small quantities but has an intrinsic blue color. It also exists on other moons and planets both beyond and within the solar system.
Steam is the gaseous form of liquid water. When liquid water boils at 100-degree temperature, it transforms into a gaseous form which is called steam.
Steam is invisible in its most natural and purest state. Most people identify steam coming out from boiling water as visible and colored white.
Практическое применение
Как молекулы воды, так и молекулы пара имеют широкое практическое применение в различных отраслях. Вот несколько областей, где используются эти материалы:
- Энергетика: Молекулы воды используются для производства пара, который применяется в генерации электроэнергии в паровых турбинах. Молекулы пара обеспечивают энергию для работы различных промышленных процессов.
- Пищевая промышленность: Вода используется в производстве пищевых продуктов, как сырье для приготовления продуктов питания, очистки и упаковки. Пар также применяется для кипячения и выпекания продуктов.
- Химическая промышленность: Вода и пар используются в различных процессах производства химических веществ, таких как синтез органических соединений, растворение и дистилляция.
- Медицина: Вода является основным компонентом в организме человека и используется в медицинских процедурах, таких как промывание ран и телесных полостей, приготовление лекарственных растворов.
- Косметическая промышленность: Вода является основной частью множества косметических продуктов, таких как кремы, лосьоны, шампуни и массажные масла. Пар также используется в процедурах косметического ухода, например, в саунах и паровых комнатах.
В целом, молекулы воды и молекулы пара играют важную роль в нашей жизни и широко применяются в различных отраслях промышленности и общественной сфере.
Физические характеристики молекул воды
Полярность: Водные молекулы являются полярными из-за разницы в электроотрицательности атомов кислорода и водорода. Это приводит к образованию диполя воды и способности молекулы воды взаимодействовать с другими полярными и ионными соединениями.
Ковалентная связь: Атомы водорода и кислорода в молекуле воды связаны ковалентной связью. Кислород привлекает электроны сильнее, что создает разницу в заряде между кислородом и водородом и положительный заряд на водородных атомах.
Водородные связи: Ковалентная связь не является единственной силой в молекуле воды. Молекулы воды также образуют водородные связи, в результате которых одна молекула воды притягивается к другой. Эта сила является ключевой для многих характеристик воды, таких как ее высокая теплота парообразования и высокое поверхностное натяжение.
Температура кипения и плавления: Молекулы воды обладают сравнительно высокой температурой кипения и плавления. Это связано с силами водородных связей между молекулами воды, которые требует большего количества энергии для разрушения связей и изменения состояния вещества.
Плотность: Молекулы воды имеют высокую плотность в сравнении с молекулами пара. Это объясняется тесным упаковыванием молекул воды благодаря водородным связям, которые приводят к образованию решетчатой структуры льда и более компактным ароматным жидкостям.
Эти физические характеристики делают молекулы воды особенными и позволяют ей существовать в трех состояниях: твердом, жидком и газообразном, и выполнять множество важных функций в биологических и физических системах.
Паровое давление
Паровое давление воды зависит от ее температуры. При низкой температуре, когда молекулы воды движутся медленно и имеют мало энергии, паровое давление невелико. Однако при повышении температуры молекулы воды приобретают больше энергии и начинают испаряться, что приводит к увеличению парового давления.
Молекулы воды в паре имеют достаточно высокую энергию, чтобы преодолеть притяжение друг к другу и лететь в пространстве. В отличие от жидкой воды, молекулы в паре не соблюдают жесткую структуру и движутся более хаотично.
Паровое давление важно для многих аспектов нашей жизни. Например, приготовление пищи в воде зависит от температуры и парового давления воды
Также паровое давление играет роль в погоде, влияя на образование облаков и выпадение осадков.
Химические свойства
Водяной пар, в свою очередь, представляет собой газообразное состояние воды при определенной температуре и давлении. Молекулы водяного пара обладают большей кинетической энергией по сравнению с молекулами воды.
Несмотря на различия в физических свойствах, молекулы водных паров и воды обладают одними и теми же химическими свойствами. Они могут реагировать с другими веществами, участвовать в химических реакциях и образовывать новые соединения.
Одна из основных химических свойств молекул воды – способность образовывать водородные связи
Это является основой многих свойств и важно для механизма растворения веществ в воде, термодинамических процессов и сложения структур биологических макромолекул
Таким образом, химические свойства молекул воды и молекул водяного пара имеют сходства и различия, которые определяют их влияние на окружающую среду и применение в различных процессах.
Реакции воды и водяного пара с другими веществами
Реакции воды и водяного пара с другими веществами могут происходить по-разному. Некоторые реакции, которые происходят с водой, также могут происходить с водяным паром, но с некоторыми отличиями.
| Реакция | Описание |
|---|---|
| Гидролиз | Гидролиз — это реакция, при которой вода разлагается на ионы водорода (H+) и гидроксидные ионы (OH-). Эта реакция может происходить как с водой, так и с водяным паром. |
| Окисление | Окисление воды — это процесс, при котором молекула воды теряет электроны и образует кислород и водород. Эта реакция может происходить как с водой, так и с водяным паром, но с различной скоростью. |
| Растворение | Растворение воды — это процесс, при котором молекулы вещества взаимодействуют с молекулами воды. Этот процесс может происходить как с водой, так и с водяным паром, но скорость растворения может отличаться. |
Таким образом, отмечается, что реакции воды и водяного пара с другими веществами имеют некоторые сходства, но также могут происходить с некоторыми отличиями из-за разницы в физическом состоянии молекул.
Взаимодействие с окружающей средой
Молекулы водяного пара и молекулы воды отличаются между собой.
Водяной пар — это газообразное состояние воды, при котором молекулы воды разделены друг от друга и могут свободно двигаться. Однако они все еще являются молекулами воды и состоят из двух атомов водорода и одного атома кислорода.
Молекулы воды, находясь в жидком состоянии, существуют в тесном взаимодействии друг с другом. Они образуют короткие связи, которые позволяют им образовывать такие структуры, как капли или океаны. Эти молекулы также состоят из двух атомов водорода и одного атома кислорода, но их межмолекулярные силы сильнее.
Таким образом, молекулы водяного пара и молекулы воды отличаются степенью взаимодействия между ними. Молекулы водяного пара свободно перемещаются и распространяются в окружающей среде, тогда как молекулы воды тесно связаны и не могут так легко двигаться. Возникают различные свойства — парообразное состояние и жидкое состояние, к которым присущи разные процессы и взаимодействия с окружающей средой.