Применение знания об особенностях молекул воды и льда в научных и промышленных целях
Молекулы воды и льда имеют ряд уникальных особенностей, которые могут быть использованы в научных и промышленных целях. Знание этих особенностей помогает разработать новые материалы, улучшить процессы и создать новые технологии.
Одной из основных особенностей молекул воды является их способность образовывать водородные связи. Это позволяет воде образовывать кластеры, при которых молекулы воды связываются между собой. Это свойство используется в различных областях, таких как фармацевтика, биология и материаловедение. Например, в фармацевтической промышленности знание об этих связях позволяет разработать более эффективные лекарственные препараты и улучшить их биодоступность.
Еще одним интересным свойством воды и льда является их высокая теплоемкость. Это означает, что для нагревания воды требуется значительное количество энергии. Такое свойство используется в различных областях, включая энергетику и пищевую промышленность. Например, высокая теплоемкость воды позволяет использовать ее в системах охлаждения, где она поглощает тепло и предотвращает перегрев оборудования.
Молекулы воды и льда также обладают высокой коэффициентом поверхностного натяжения. Это свойство позволяет воде образовывать пленки на различных поверхностях и обеспечивает сцепление между частицами. Это свойство используется в промышленности для создания клеев, покрытий и смазок. Например, знание об этом свойстве молекул воды позволяет создавать клейкие материалы, которые используются в производстве электроники и автомобильной промышленности.
Таким образом, знание об особенностях молекул воды и льда имеет широкое применение в различных научных и промышленных областях. Это помогает разработать новые материалы, улучшить процессы и создать новые технологии. Использование этих знаний способствует развитию современного общества и прогрессу в науке и промышленности.
Мне нравитсяНе нравится
Гидратация и растворимость
Вода способна образовывать гидратные соединения с различными веществами, такими как соли, кислоты, основания и другие химические соединения. Процесс гидратации происходит благодаря образованию взаимодействий между положительно или отрицательно заряженными ионами вещества и дипольными молекулами воды.
Растворимость вещества в воде зависит от его способности образовывать гидраты. Такие вещества, которые образуют стабильные гидраты, обычно легко растворяются в воде. Например, многие соли, такие как хлорид натрия (NaCl) и сульфат меди (II) (CuSO4), образуют гидратные соединения и хорошо растворяются в воде.
С другой стороны, вещества, которые не могут образовывать стабильные гидраты, имеют низкую растворимость в воде. Например, жирные кислоты, такие как олеиновая кислота и стеариновая кислота, не образуют гидраты и плохо растворяются в воде.
Важно отметить, что образование гидратов может сильно влиять на физические и химические свойства вещества, такие как плотность, температура плавления и точка кипения
Различия молекул воды и молекул льда
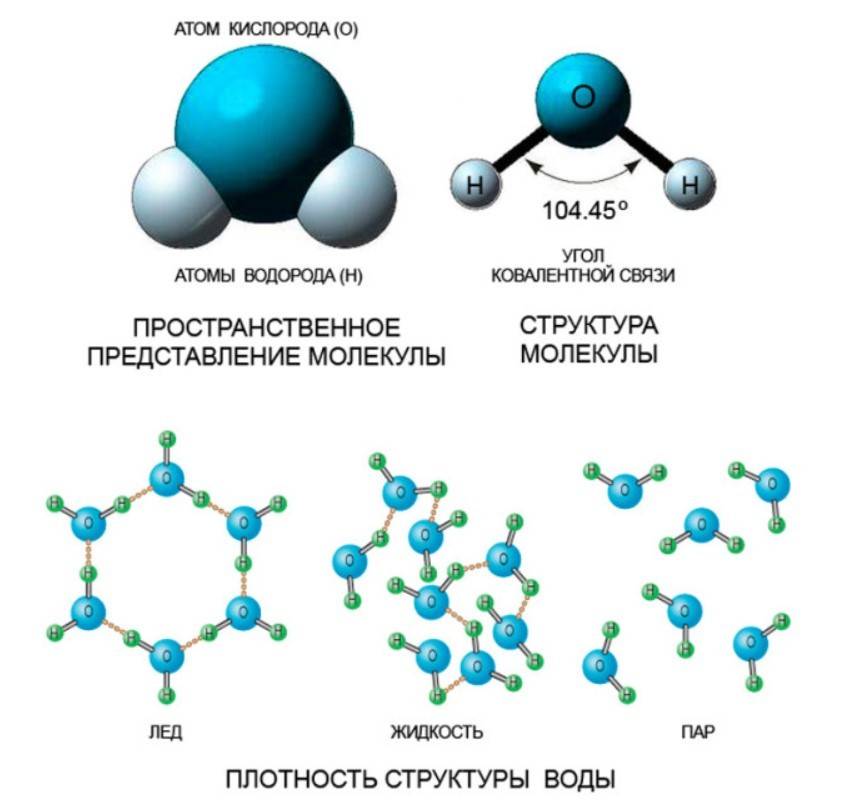
Вода в жидком состоянии представлена молекулами H2O, которые связаны между собой слабыми водородными связями. Отсутствие строгого порядка в расположении молекул позволяет воде быть подвижной и способной к изменению формы.
В свою очередь, вода при замерзании образует лед, состоящий из молекул воды, упорядоченных в кристаллическую решетку. Здесь молекулы держатся более плотно друг к другу, формируя регулярную структуру. Именно благодаря этой решетке лед обладает жесткостью и сохраняет свою форму.
Одной из особенностей молекул воды является их полярность. В молекуле воды атом кислорода притягивает к себе электроны, создавая отрицательный заряд, тогда как атомы водорода получают положительный заряд. Эта полярность делает воду хорошим растворителем для различных веществ.
В ледяных молекулах эта полярность также сохраняется, но из-за упорядоченной структуры она проявляется в другом виде. Молекулы воды во льду выстраиваются в виде решетки, и за счет этой особенности лед обладает рядом уникальных свойств, таких как плавление и кристаллизация при определенных температурах.
Интересный феномен
Горячая вода замерзает быстрее холодной. Если мы возьмем два одинаковых стакана и нальем в один горячей воды, а в другой столько же холодной, то мы заметим, что горячая вода замерзнет быстрее, чем холодная. Это не логично, согласитесь? Горячей воде нужно остыть, чтобы начинать замерзать, а холодной этого не нужно. Как объяснить данный факт? Ученые по сей день не могут объяснить эту загадку. Данный феномен имеет название «Эффект Мпембы». Открыт был в 1963 году ученым из Танзании при необычном стечении обстоятельств. Студент хотел сделать себе мороженое и заметил, что горячая вода замерзает быстрее. Об этом он поделился со своим учителем физики, который сначала не поверил ему.
Движение молекул воды и льда
Молекулы воды и льда обладают различными свойствами и двигаются по-разному.
Вода в жидком состоянии представляет собой совокупность молекул, которые двигаются свободно и не имеют определенной структуры. Они постоянно взаимодействуют между собой, образуя водяные связи. При этом, молекулы воды перемещаются, меняя свое положение, а их скорость движения зависит от температуры вещества. Когда вода нагревается, скорость движения молекул увеличивается, а когда охлаждается – уменьшается.
Вода может перемещаться как внутри жидкости, так и в пределах ее поверхности. Например, при выпаривании воды из озера или моря, молекулы воды испаряются и поднимаются в атмосферу. Этот процесс называется испарением. Когда вода находится в движении, например, при движении реки, молекулы воды совершают колебательные движения, перемещаясь вверх и вниз.
Молекулы льда, в отличие от молекул воды, имеют упорядоченную сетчатую структуру и находятся в статическом состоянии. Они занимают определенные устойчивые положения и могут только вращаться вокруг своей оси или колебаться на месте. Из-за этого, лед является твердым веществом и обладает определенной формой.
В процессе замораживания жидкой воды молекулы начинают организовываться в определенный способ, формируя кристаллическую решетку. Это вызывает увеличение плотности молекул и их упорядоченное движение. При этом, тепловая энергия молекул уменьшается, что приводит к образованию льда при низкой температуре.
Таким образом, движение молекул воды и льда отличается по своей природе: вода движется свободно и имеет более хаотическую структуру, а лед обладает упорядоченным статическим движением.
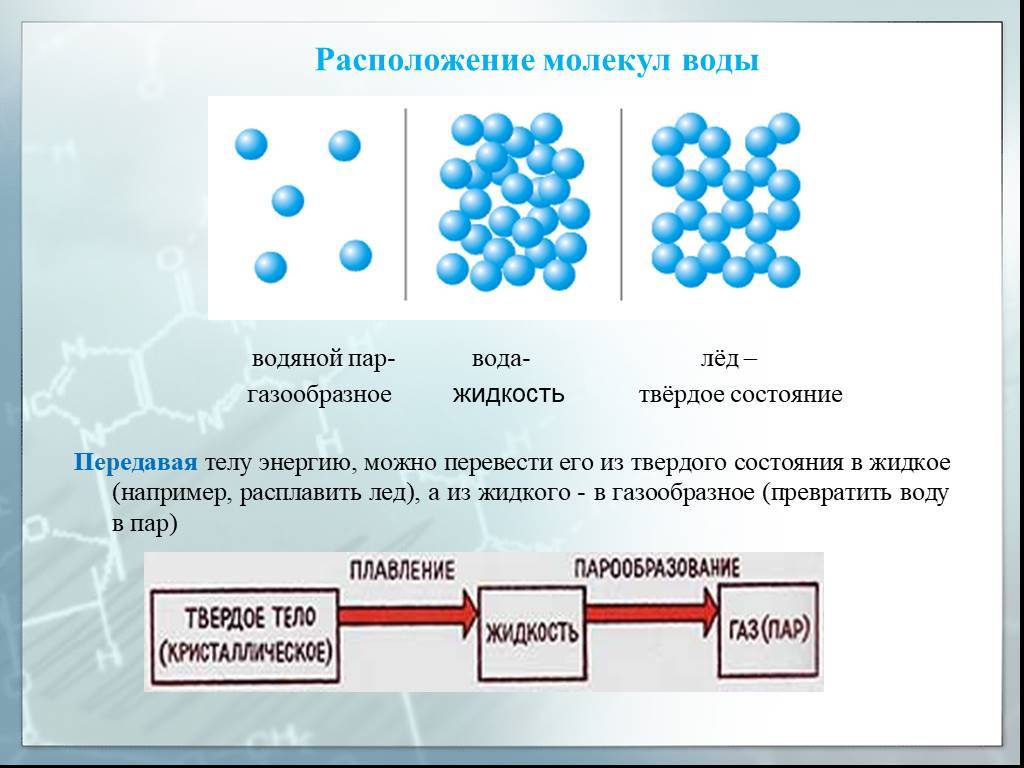
Особенности воды в твердом, жидком и газообразном состояниях
В твердом состоянии вода принимает форму льда. Молекулы воды в этом состоянии представлены в виде кристаллической решетки, где положение и связи между молекулами организованы в определенном порядке. Особенностью льда является его открытая решетка, благодаря которой лед имеет большую плотность в сравнении с жидкой водой. Именно поэтому лед плавает на поверхности воды.
В жидком состоянии вода обладает меньшей плотностью, чем в твердом состоянии. Молекулы воды в жидкости находятся в непостоянном движении, совершая быстрые вибрационные и вращательные движения. Жидкая вода может принимать форму и объем сосуда, в котором находится.
В газообразном состоянии вода превращается в пар. Молекулы воды в газе находятся в быстром хаотическом движении, часто сталкиваясь и отталкиваясь друг от друга. Газообразная вода имеет самые высокие значения кинетической энергии и воспринимается как невидимый пар.
| Состояние | Особенности |
|---|---|
| Твердое | Молекулы организованы в кристаллическую решетку, большая плотность, лед плавает на поверхности воды. |
| Жидкое | Молекулы находятся в непостоянном движении, меньшая плотность, принимает форму и объем сосуда. |
| Газообразное | Молекулы в быстром и хаотичном движении, самая высокая кинетическая энергия, представляется в виде невидимого пара. |
Особенности воды в твердом, жидком и газообразном состояниях определяют ее роль в жизни на Земле. Как твердый лед, она участвует в формировании ледников и горного рельефа. В жидком состоянии она является основным растворителем и средой для многих химических реакций. В газообразной форме она участвует в круговороте воды в атмосфере и является одним из важнейших факторов климата на планете.
Влияние молекул воды и ледяного пара на окружающую среду
Молекулы воды и ледяного пара имеют значительное влияние на окружающую среду и играют важную роль в климатических процессах в разных частях мира.
Молекулы воды в жидком состоянии, известные как вода, являются ключевыми участниками гидрологического цикла. Вода испаряется из океанов, рек, озер и почвы под воздействием тепла от Солнца. Водяные парами поднимаются в атмосферу, где они охлаждаются и конденсируются с образованием облачных частиц и атмосферного влажностного содержания. Эти облака могут затем выпадать в виде осадков, таких как дождь, снег или град.
Ледяной пар, или водяной пар, непосредственно воздействует на климатическую систему Земли. Он является главным фактором вогнутости земли и создает эффект парниковых газов. Ледяной пар является одним из основных парниковых газов, который удерживает часть тепла от Солнца, сохраняя планету в меру теплой.
Молекулы воды и ледяного пара также играют важную роль в климатических моделях и прогнозах. Их распределение в атмосфере, количество и форма осадков, их перемещение и концентрация в разных регионах мира могут значительно влиять на погоду и климат.
- Молекулы воды влияют на влажность воздуха, облака и осадки.
- Ледяной пар является одним из парниковых газов, способствующих сохранению тепла на Земле.
- Распределение и концентрация воды и ледяного пара существенно влияют на погодные условия и климат.
- Механизмы формирования осадков, связанные с молекулами воды и ледяного пара, определяют типы осадков и их интенсивность.
- Изменение количества и качества воды и ледяного пара в атмосфере может вызвать изменения в климате и погоде, влияющие на живые организмы и экосистемы.
Понимание влияния молекул воды и ледяного пара на окружающую среду и климат является ключевым для улучшения наших знаний о изменениях климата и принятия мер для его смягчения и приспособления.
Тепловые свойства воды и льда пара
Вода и лед пар содержат разные тепловые свойства, так как их молекулярная структура и состояние различны.
Вода – это жидкость, которая обладает высокой теплоемкостью. Это означает, что для нагрева или охлаждения воды требуется значительное количество тепла. Вода также имеет высокую теплопроводность, что означает, что она очень хорошо передает тепло.
Лед пар, с другой стороны, является твердым веществом, и его тепловые свойства отличаются от свойств жидкой воды. Лед пар имеет низкую теплоемкость, что означает, что для нагрева или охлаждения льда пара требуется меньшее количество тепла, чем для аналогичного изменения температуры воды. Лед пар также имеет низкую теплопроводность, что означает, что он плохо передает тепло.
Однако, несмотря на различия в их тепловых свойствах, вода и лед пар все же образуют одну и ту же химическую вещество – молекула H2O. Это означает, что они имеют схожие химические свойства и способность взаимодействовать с другими веществами.
Важно отметить, что при нагревании льда пара, он превращается в жидкую воду, и при охлаждении воды она может превращаться в лед пар. Это так называемые фазовые переходы, которые происходят при определенных температурах и давлениях.
Одно из интересных свойств воды и льда пара – это их плотность
В жидкой форме вода имеет наибольшую плотность при температуре около 4 градусов Цельсия. Это означает, что холодная вода будет тонуть, а теплая будет плавать.
На самом деле, это очень важная особенность для живых организмов, поскольку она обеспечивает формирование льда на поверхности водоемов, что изолирует нижние слои воды от холода и позволяет поддерживать их более стабильной температуру.
Также, известно, что лед пар имеет большую объемную площадь по сравнению с плавающими водой. Это связано с упорядоченной структурой его молекул, которая образует симметричные кристаллические решетки.
Из-за этой своеобразной «решетчатости» лед пар является прочным и твердым материалом, что делает его используемым в различных инженерных и строительных проектах.
Таким образом, тепловые свойства воды и льда пара — одна из множества характеристик, которые делают эти два состояния вещества уникальными и полезными в различных сферах нашей жизни.
Молекулы воды и их особенности
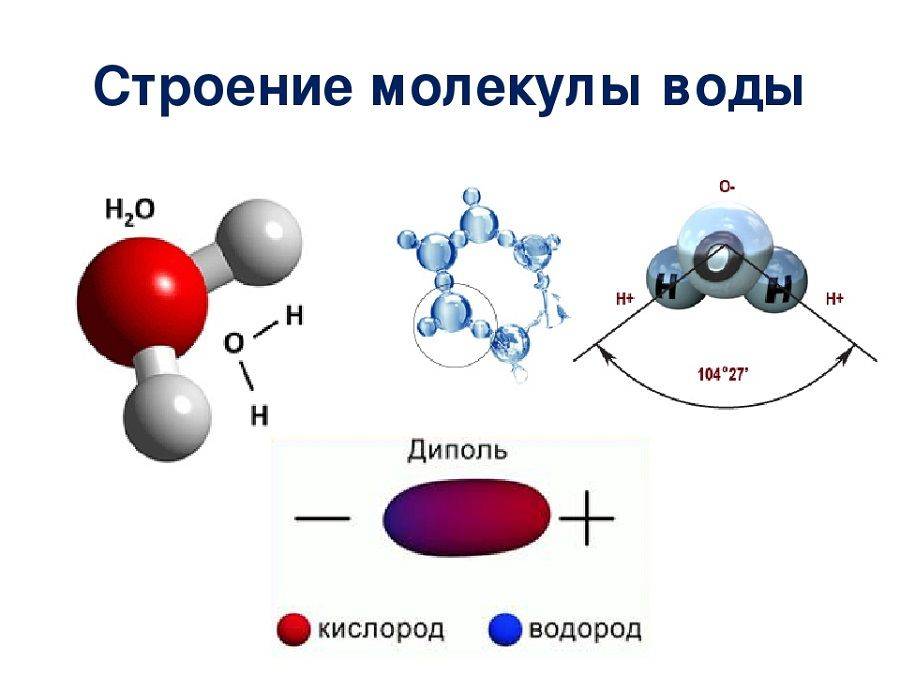
Молекулы воды состоят из атомов водорода и атома кислорода, соединенных ковалентными связями. Каждая молекула воды имеет два водородных атома и один кислородный атом.
Особенностью молекул воды является их полярность. Это означает, что водные молекулы имеют намагниченность, с положительно заряженным кислородом и отрицательно заряженными водородными атомами. Именно благодаря полярности молекулы воды образуют водородные связи между собой, что делает воду жидкостью при комнатной температуре.
Кроме того, молекулы воды обладают способностью образовывать кластеры, в которых молекулы связаны друг с другом с помощью водородных связей. Эта особенность оказывает влияние на свойства воды, такие как поверхностное натяжение и капиллярное действие.
Важно отметить, что при замораживании воды молекулы упорядочиваются и образуют регулярную структуру, называемую кристаллической решеткой льда. В результате образуются шестигранные призмы, внутри которых молекулы воды расположены по определенным углам
Это приводит к увеличению объема и снижению плотности льда по сравнению с жидкой водой, что обеспечивает плавание льда на поверхности воды.
| Свойство | Молекулы воды |
|---|---|
| Количество атомов водорода | 2 |
| Количество атомов кислорода | 1 |
| Полярность | Да |
| Водородные связи | Присутствуют |
| Кристаллическая структура | Шестигранные призмы |
| Плотность льда по сравнению с жидкой водой | Ниже |
Движение молекул в газах, жидкостях и твёрдых телах
Молекулярно-кинетическая теория даёт объяснение тому, что все вещества могут находиться в трёх агрегатных состояниях: в твёрдом, жидком и газообразном. Например, лёд, вода и водяной пар. Часто плазму считают четвёртым состоянием вещества.
Агрегатные состояния вещества (от латинского aggrego – присоединяю, связываю) – состояния одного и того же вещества, переходы между которыми сопровождаются изменением его физических свойств. В этом и заключается изменение агрегатных состояний вещества.
Во всех трёх состояниях молекулы одного и того же вещества ничем не отличаются друг от друга, меняется только их расположение, характер теплового движения и силы межмолекулярного взаимодействия.
Движение молекул в газах
В газах обычно расстояние между молекулами и атомами значительно больше размеров молекул, а силы притяжения очень малы. Поэтому газы не имеют собственной формы и постоянного объёма. Газы легко сжимаются, потому что силы отталкивания на больших расстояниях также малы. Газы обладают свойством неограниченно расширяться, заполняя весь предоставленный им объём. Молекулы газа движутся с очень большими скоростями, сталкиваются между собой, отскакивают друг от друга в разные стороны. Многочисленные удары молекул о стенки сосуда создают давление газа.
Движение молекул в жидкостях
В жидкостях молекулы не только колеблются около положения равновесия, но и совершают перескоки из одного положения равновесия в соседнее. Эти перескоки происходят периодически. Временной отрезок между такими перескоками получил название среднее время оседлой жизни (или среднее время релаксации) и обозначается буквой τ. Иными словами, время релаксации – это время колебаний около одного определённого положения равновесия. При комнатной температуре это время составляет в среднем 10-11 с. Время одного колебания составляет 10-12…10-13 с.
Время оседлой жизни уменьшается с повышением температуры. Расстояние между молекулами жидкости меньше размеров молекул, частицы расположены близко друг к другу, а межмолекулярное притяжение велико. Тем не менее, расположение молекул жидкости не является строго упорядоченным по всему объёму.
Жидкости, как и твёрдые тела, сохраняют свой объём, но не имеют собственной формы. Поэтому они принимают форму сосуда, в котором находятся. Жидкость обладает таким свойством, как текучесть. Благодаря этому свойству жидкость не сопротивляется изменению формы, мало сжимается, а её физические свойства одинаковы по всем направлениям внутри жидкости (изотропия жидкостей). Впервые характер молекулярного движения в жидкостях установил советский физик Яков Ильич Френкель (1894 – 1952).
Движение молекул в твёрдых телах
Молекулы и атомы твёрдого тела расположены в определённом порядке и образуют кристаллическую решётку. Такие твёрдые вещества называют кристаллическими. Атомы совершают колебательные движения около положения равновесия, а притяжение между ними очень велико. Поэтому твёрдые тела в обычных условиях сохраняют объём и имеют собственную форму.
Уникальные свойства молекул воды
Молекулы воды обладают рядом уникальных свойств, которые делают эту вещество особенным и значимым в природе.
Полярность. Одно из главных свойств молекул воды — их полярность. Водные молекулы состоят из атомов кислорода и водорода, при этом электроны в молекуле смещены в сторону кислородного атома. Это создает положительный заряд на водородных атомах и отрицательный на кислородном. Такая полярность молекул воды обуславливает множество ее свойств, таких как способность к образованию водородных связей и высокую теплоту парообразования.
Водородные связи. Вода обладает уникальной способностью образовывать водородные связи. Это особый вид химической связи, когда водородный атом, который является положительным, притягивается к отрицательно заряженному атому. Это обеспечивает структурную устойчивость воды и способствует ее высокой коэрзивности.
Тепловая инертность. Вода обладает высокой тепловой инертностью, что делает ее отличным амортизатором перепадов температур. Благодаря водородным связям, при нагревании вода поглощает большое количество энергии и задерживает нагревание своего тела. Это позволяет использовать воду в природе для поддержания стабильной температуры в океанах, реках и озерах, а также в организмах живых существ.
Высокая плотность льда. Вода обладает особенностью, которую не имеет большинство других веществ — лед имеет более низкую плотность, чем жидкая вода. Это происходит благодаря структуре водородных связей в льде, которая формирует кристаллическую решетку
Этот факт имеет важное значение для живых организмов, так как позволяет им выживать в зимний период, когда поверхность водоемов замерзает, а нижние слои остаются жидкими
Универсальный растворитель. Вода является универсальным растворителем, то есть способна растворять многие вещества. Это связано с ее полярностью и способностью образовывать водородные связи. Благодаря этому свойству вода способна переносить и доставлять различные вещества в организмах живых организмов, а также принимать участие во многих химических реакциях.
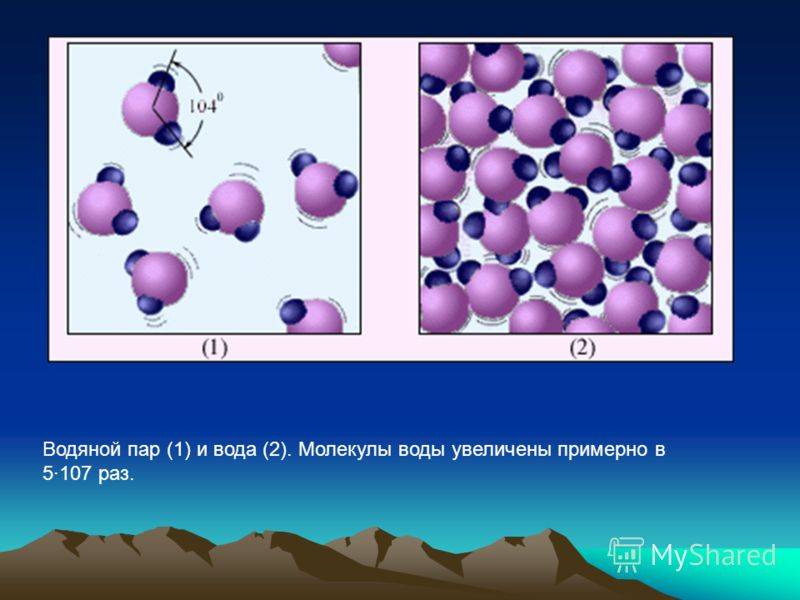
Что отличает молекулы пары воды и льда?
1. Форма и объем: молекулы пары воды обладают любой формой и заполняют объем, в котором расположены, тогда как молекулы льда имеют определенную кристаллическую форму и ограниченный объем.
2. Расстояние между молекулами: вода в парообразном состоянии обладает высокой подвижностью и молекулы находятся на значительном расстоянии друг от друга, в то время как вода в ледяном состоянии имеет более плотную структуру с ближе расположенными молекулами.
3. Теплота плавления и кипения: переход воды из твердого состояния в жидкое осуществляется при температуре плавления 0 градусов Цельсия, а переход воды из жидкого состояния в газообразное — при температуре кипения 100 градусов Цельсия. Таким образом, процессы плавления и кипения воды сопровождаются поглощением большого количества теплоты.
4. Межмолекулярные взаимодействия: вода в паре характеризуется слабыми межмолекулярными взаимодействиями, тогда как лед обладает сильными водородными связями между молекулами, что объясняет его устойчивость и кристаллическую структуру.
5. Плотность и плавучесть: пара воды менее плотна, чем жидкая или твердая вода, поэтому может быть использована для создания подъемной силы. Лед, наоборот, имеет меньшую плотность, чем жидкая вода, поэтому плавает на поверхности воды.
В целом, молекулы пары воды и льда различаются как по своей физической структуре, так и по своим свойствам
Понимание этих различий важно для понимания различных аспектов химии и физики воды