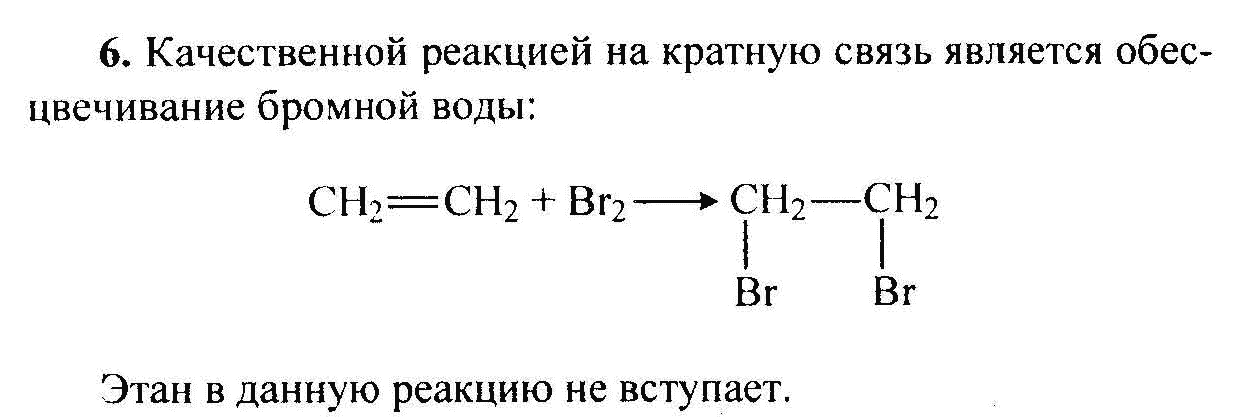
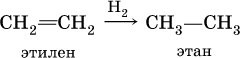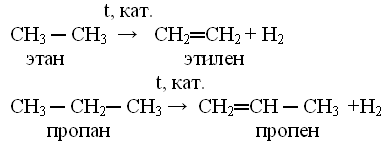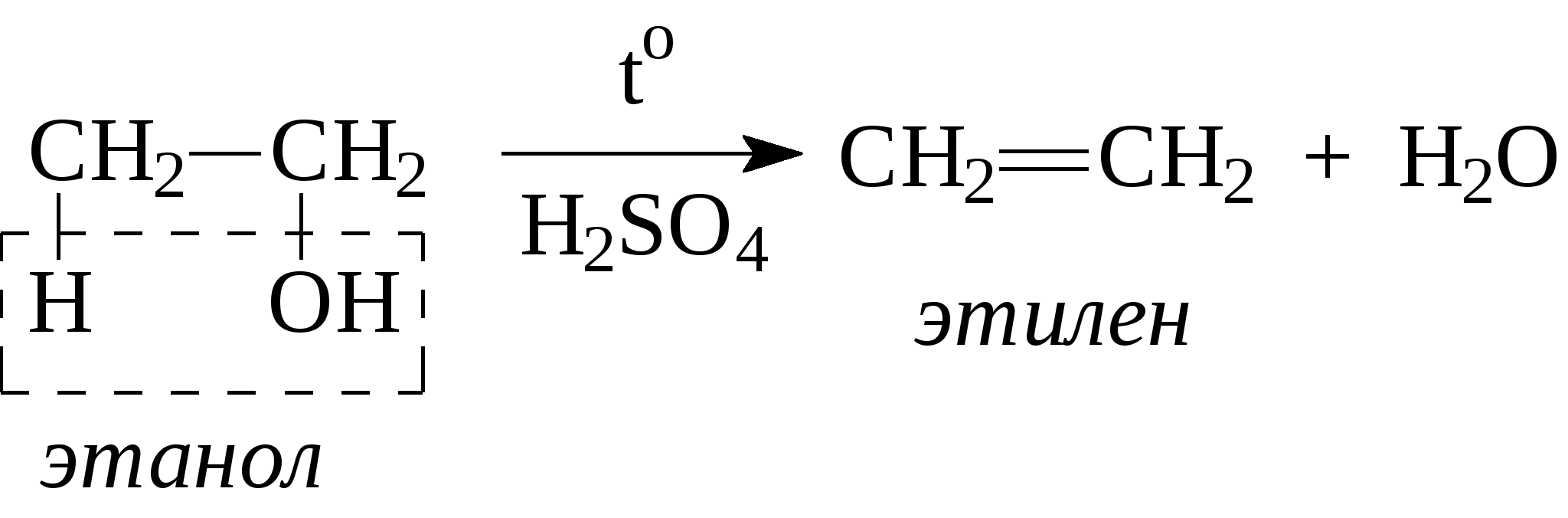Метод 3: Использование инфракрасной спектроскопии
Чтобы различить этилен и этан с помощью инфракрасной спектроскопии, нужно обратить внимание на пики, которые соответствуют различным связям в молекулах. Этилен имеет двойную связь между углеродами, что приводит к появлению пика около 1650 см^-1
Этан же, не содержащий двойной связи, имеет пик около 2950 см^-1, который свидетельствует о наличии одиночных связей C-H.
Таблицы инфракрасных поглощений могут быть использованы для сравнения спектров и установления отличий между этаном и этиленом. Если обнаружены пики, характерные для двойной связи, это может указывать на наличие этилена.
Кроме того, инфракрасная спектроскопия также может использоваться для определения концентрации указанных веществ в смесях. Спектры также способны показать наличие или отсутствие других функциональных групп в молекулах, что может быть полезно в процессе различения этилен и этан.
Главное отличие – этан против этена
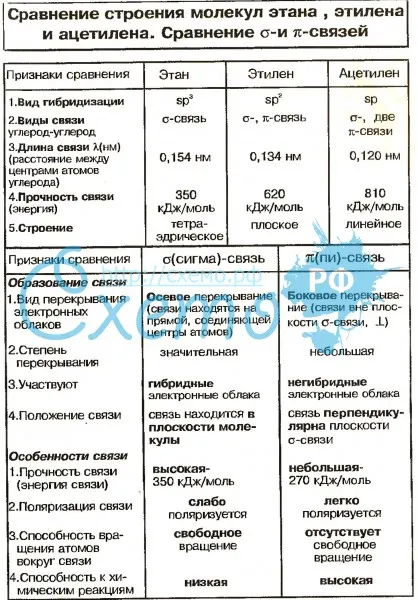
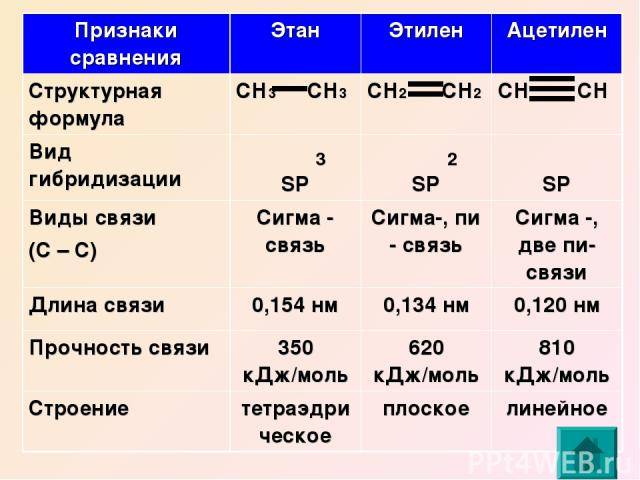
Углеводороды – это молекулы, состоящие из атомов углерода (C) и водорода (H). Большинство углеводородов содержится в сырой нефти. Этан и этен являются такими углеводородами, которые имеют простую молекулярную структуру, но очень полезны во многих отраслях промышленности. Этан является насыщенным углеводородом. У него нет двойных связей. Этен является ненасыщенным углеводородом. У него двойная связь. Однако оба являются алифатическими углеводородами, поскольку они не являются циклическими структурами. Основное различие между этаном и этеном что атомы углерода этана являются sp3 гибридизуется, тогда как атомы углерода в этене являются sp2 гибридизовал.
Ключевые области покрыты
1. Что такое этан – определение, свойства, применение2. Что такое этен – определение, свойства, применение3. В чем сходство этана и этена – Краткое описание общих черт4. В чем разница между этаном и этеном – Сравнение основных различий
Ключевые термины: алифатический, этан, этен, этилен, гибридизация, углеводороды, пи-бонды, сигма-бонды.
Рекомендации при работе с этиленом и этаном
Работа с химическими веществами, такими как этилен и этан, требует особой осторожности и знания применяемых правил безопасности. Вот несколько полезных рекомендаций при работе с этими веществами:. 1
Хранение:
1. Хранение:
Храните этилен и этан в хорошо вентилируемых и изолированных от источников огня помещениях. Обеспечьте соответствующие условия температуры и влажности для предотвращения возникновения аварийных ситуаций.
2. Передвижение:
Перед перемещением контейнеров с этиленом или этаном убедитесь, что они надежно закрыты и правильно маркированы. Используйте соответствующие средства и технику для безопасного перемещения.
3. Использование защитных средств:
При работе с этиленом и этаном необходимо использовать защитные средства, такие как защитные очки, перчатки, халаты и маски, чтобы предотвратить контакт с кожей, глазами или дыхательной системой. Ознакомьтесь с инструкциями по использованию и обслуживанию средств индивидуальной защиты перед началом работы.
4. Вентиляция:
Обеспечьте эффективную вентиляцию рабочих помещений, чтобы избежать скопления паров этилена или этана. Тщательно изучите инструкции по установке и обслуживанию систем вентиляции и убедитесь, что они функционируют должным образом.
5. Аварийная ситуация:
В случае возникновения аварийной ситуации с этиленом или этаном, немедленно примите меры по обеспечению своей безопасности и безопасности окружающих. Закройте и изолируйте источник утечки, уведомьте соответствующие службы и следуйте их рекомендациям.
Соблюдение этих рекомендаций поможет обеспечить безопасность при работе с этиленом и этаном. Однако, всегда необходимо также руководствоваться инструкциями производителя и соблюдать местные правила безопасности.
Методы различения этана и этилена
Один из методов различения основан на различии в физических свойствах этилена и этана. Этилен является газом при комнатной температуре и давлении, в то время как этан является жидкостью. Это позволяет легко различить два соединения по их агрегатному состоянию.
Другим методом различения является проведение химической реакции между этаном и этиленом с хлором. Этан не реагирует с хлором, в то время как этилен образует основной продукт реакции – 1,2-дихлорэтан. Это позволяет определить наличие этилена в пробе.
Использование специальных индикаторов является еще одним методом различения этана и этилена. Например, в присутствии брома, этилен окрашивается в ярко-желтый цвет, в то время как этан остается без изменений. Это позволяет наглядно отличить этилен от этана.
Газохроматография – это метод анализа, который используется для определения содержания различных компонентов смеси. Он также может быть использован для различения этана и этилена. Газохроматографический анализ позволяет определить различия в подвижности этилена и этана в газовой фазе, что делает возможным определить наличие и концентрацию каждого из этих соединений.
| Метод | Преимущества | Недостатки |
|---|---|---|
| Физические свойства | Простота проведения | Не всегда точный результат |
| Химическая реакция с хлором | Наглядное отличие | Ограниченная специфичность |
| Использование специальных индикаторов | Простота визуального анализа | Низкая точность |
| Газохроматография | Высокая точность и чувствительность | Требует специального оборудования |
Полученные данные могут быть использованы для дальнейшего анализа и исследования свойств и реакционной способности этана и этилена. Они могут также быть полезны при определении наличия и концентрации этилена в промышленных и жизненных ситуациях.
Использование специальных индикаторов
Этилен провоцирует выделение газового брома из бромной воды, образуя бесцветное соединение и выделяя вследствие этого желтоватый цвет. В случае с этаном нет никакой реакции. Используя этот метод, можно с легкостью определить наличие этилена в различных смесях газов.
Также существует другой специальный индикатор — маркированный газ. Для этого метода применяют газ с добавкой химического вещества, которое образует видимое пятно или облако при контакте с этиленом. В случае с этаном определенной реакции не происходит. Таким образом, можно легко различить этилени и этан, используя маркированный газ.
Использование специальных индиакторов может быть полезным инструментом в лаборатории или в промышленной сфере для точного определения наличия этилена и этана в различных смесях газов.
Газохроматография
Применительно к отличению этилена от элана, газохроматография может быть очень полезным инструментом. Этот метод основан на разделении компонентов смеси на основе их различной аффинности к стационарной фазе или капилляру.
Процесс анализа начинается с введения смеси в газохроматографическую систему через инжектор. Затем газовая смесь проходит через колонку, которая содержит стационарную фазу. Колонка может быть заполненной или капиллярной.
Компоненты смеси взаимодействуют с стационарной фазой и мигрируют по колонке с различными скоростями. По мере прохождения через колонку, компоненты смеси регистрируются детектором, который создает электрический сигнал. Этот сигнал анализируется, и на основе времени удержания или других характеристик, можно определить наличие или отсутствие определенного компонента в смеси.
Газохроматография обычно реализуется с использованием специализированного оборудования, такого как газовый хроматограф. Преимуществами этого метода являются его высокая точность, повторяемость и возможность анализировать очень малые количества вещества в смеси.
В отличие от других методов определения, газохроматография позволяет проводить анализ в реальном времени, что делает ее очень полезным инструментом для многих областей, включая диагностику, научные исследования и процессы производства.
Таким образом, газохроматография является эффективным и точным методом определения различий между этаном и этиленом, что позволяет устанавливать состав смесей и проводить качественный анализ химических соединений.
Видео:Получение и изучение свойств этилена. Опыт 2Скачать

Презентация на тему: ” Этилен и его гомологи Непредельные углеводороды. Этилен – этен В чем отличие молекулы этилена от молекулы этана? Каким образом можно получить из этана.” — Транскрипт:
1
Этилен и его гомологи Непредельные углеводороды

2
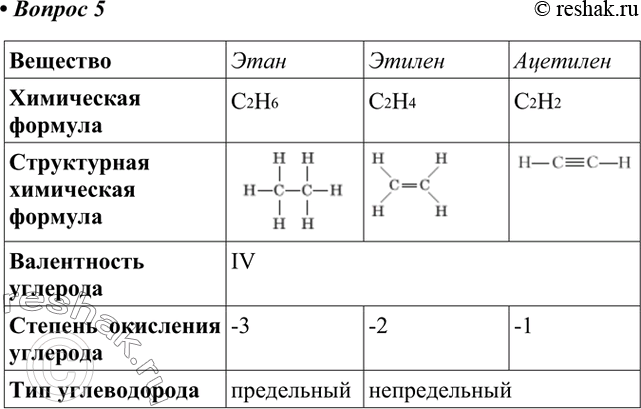
Этилен – этен В чем отличие молекулы этилена от молекулы этана? Каким образом можно получить из этана этилен и наоборот ? С 2 Н 6 этан С 2 Н 4 этилен

3
Реакция дегидрирования – это реакции отщепления атомов водорода от молекул органических веществ. Составьте уравнение дегидрирования этана

4
Этилен – этен Составьте структурную формулу этилена. Почему этот углеводород называют непредельным? Какой гомологический ряд органических веществ будет начинать этилен? Выведите общую формулу этого ряда углеводородов.

5
Непредельные углеводороды – это органические вещества, молекулы которых содержат двойные или тройные связи и не насыщены до предела атомами водорода.

6
Алкены Это непредельные углеводороды, молекулы которых содержат одну двойную связь, с общей формулой C n H 2n

7
Алкены Составьте и назовите структурные формулы гомологов этилена с 3 и 4 атомами углерода. Найдите формулы алкенов в 3 на стр.143 печатной тетради

8
Получение этилена в лаборатории Чем молекула спирта отличается от молекулы этилена? Составьте уравнение реакции получения этилена из этилового спирта С 2 Н 5 ОН этиловый спирт

9
Реакция дегидратации – это реакция отщепления воды от молекул веществ. Какую реакцию называют гидратацией? Гидратация – это присоединение молекул воды к молекулам непредельных веществ

10
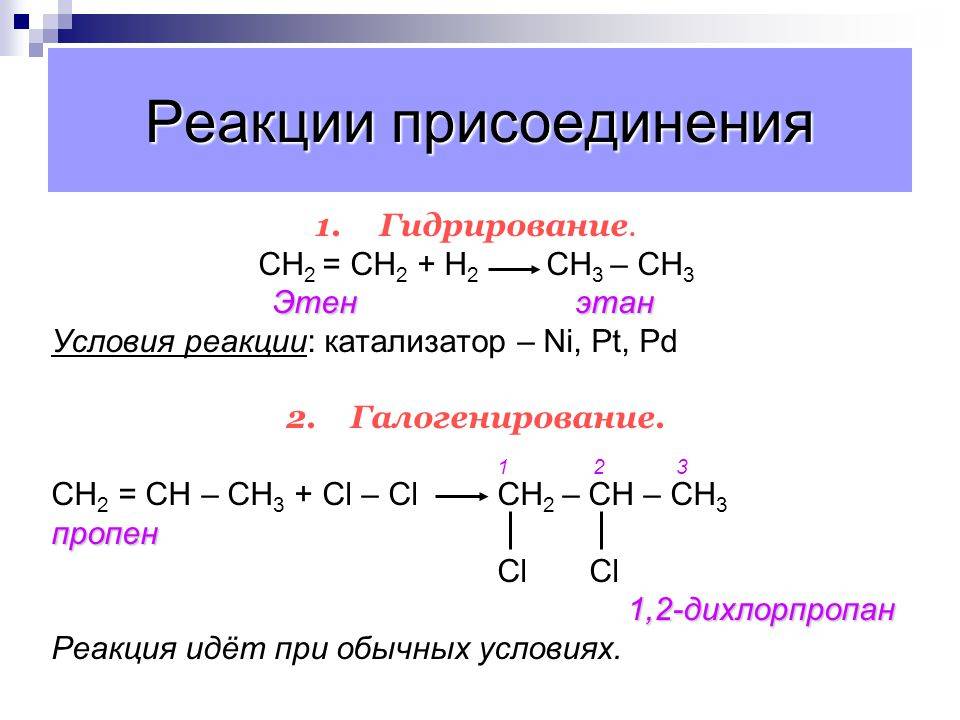
Химические свойства этилена Запомните! Для непредельных углеводородов характерны реакции присоединения (насыщения связей), с разрывом двойных связей и образовании одинарных связей.

11
Химические свойства этилена Запомните! Присоединяться могут : 1. молекулы водорода (гидрирование); 2. молекулы воды (гидратация); 3. молекулы галогенов (брома и хлора); 4. соединение в огромную молекулу – полимеризация.

12
Химические свойства этилена Запомните! Качественными реакциями на определение в молекулах двойных связей является обесцвечивание растворов марганцовки и бромной воды (раствора брома в воде).

13
Применение этилена Почему реакцию горения этилена экономически не выгодно использовать для получения энергии? Этилен в больших количествах используют как химическое сырье для производства полиэтилена и других ценных органических веществ

14
Химические свойства этилена Выполните упражнение 6 на стр. 145 в печатной тетради с помощью текста учебника. Найдите в учебнике и запишите определения в 7 на стр.145 в печатной тетради

15
Задание на дом Параграф 33, 1-3 всем, 4-5 на «4» и «5». Выучить все определения!

Определение присутствия этилена и этана в смеси газов
Для проведения анализа необходимо создать газовую смесь, содержащую этилен и этан, и подать ее на хроматографическую установку. Хроматограф разделяет компоненты смеси на основе различий в их аффинности к стационарной фазе и мобильной фазе.
| Этилен | Этан | |
|---|---|---|
| Молекулярная формула | C2H4 | C2H6 |
| Физическое состояние при комнатной температуре | Газ | Газ |
| Реакционная способность | Способен претерпевать полимеризацию | Не обладает реакционной способностью |
| Присутствие двойной связи | Содержит две двойные связи | Не содержит двойной связи |
После проведения газовой хроматографии можно получить график, на котором отраженны пики для каждого из компонентов смеси. Определяя время удерживания каждого пика, возможно определить соотношение этилена и этана в газовой смеси.
Таким образом, используя методику газовой хроматографии, можно определить присутствие и соотношение этилена и этана в смеси газов, что позволяет установить их концентрацию и провести нужные аналитические исследования.
Горение
Горение осуществляется в определенных условиях, таких как наличие кислорода, достаточная температура и наличие источника зажигания. Когда эти условия соблюдаются, горючее вещество начинает окисляться и происходит цепная реакция, в результате которой вещество сгорает.
Главными компонентами горения являются топливо, кислород и источник зажигания. Топливо может быть различным — это может быть газ, жидкость или твердое вещество. Например, в качестве топлива для горения в машинах используется бензин или дизельное топливо, которые смешиваются с кислородом из воздуха, и искра от свечи зажигания дает начало процессу горения.
Горение — это процесс, который мы встречаем ежедневно в нашей жизни. Например, когда мы зажигаем свечу, горит костер или газовая плита, это все примеры горения. Горение также используется для производства энергии, например, в электростанциях, где топливо сжигается для привода турбины, которая вращает генератор и производит электричество.
Горение является важным процессом, который способствует преобразованию энергии и обеспечивает нашу повседневную жизнь. Без горения мы бы не имели доступа к таким удобствам, как свет, тепло и транспортное средство.
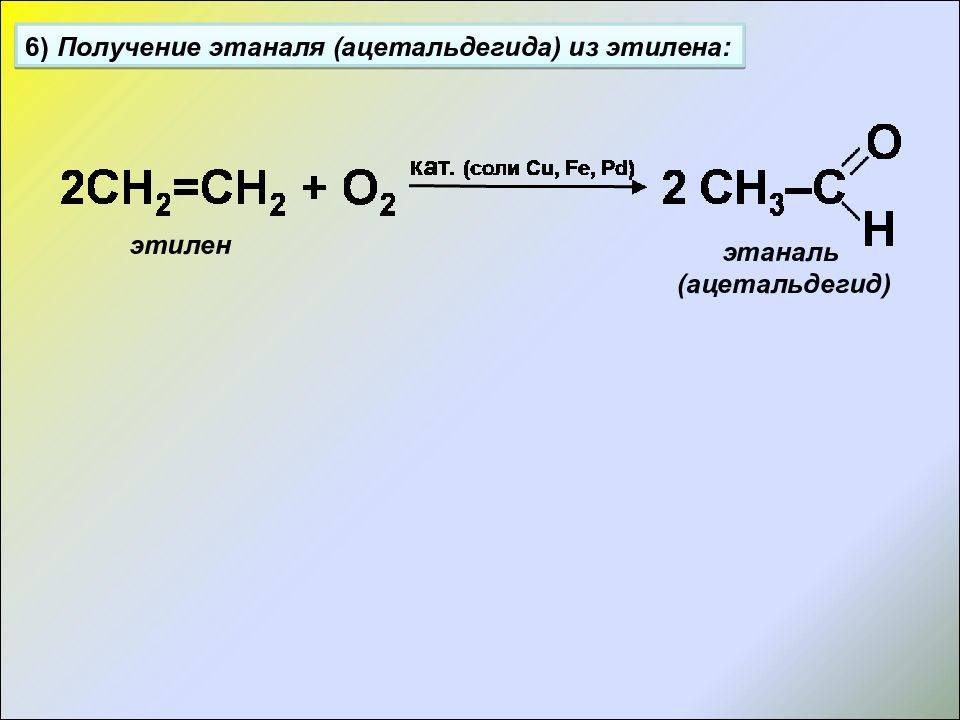
Химические реакции этилена и этана
Этилен, также известный как этилен (С2Н4), обладает двойной связью между атомами углерода. Эта двойная связь делает его нестабильным и вместе с тем предоставляет много возможностей для химической реактивности. Некоторые характерные реакции этилена включают:
- Полимеризация: этилен может претерпевать полимеризацию, образуя полиэтилен.
- Горение: этилен горит без дыма и с относительно чистым пламенем.
- Гидрирование: этилен может быть гидрирован в этилэтилен или другие продукты.
- Гидрохлорирование: экспонирование этилена к газообразному хлору приводит к образованию винилхлорида.
Этан, с другой стороны, обладает одинарной связью между атомами углерода. Несмотря на то, что этан более стабилен, у него все же есть свои характерные химические реакции:
- Горение: этан горит, образуя воду и углекислый газ.
- Галогенизация: этан может реагировать с галогенами (хлор, бром, йод), образуя соответствующие галогениды.
- Гидрирование: в присутствии катализатора этан может быть гидрирован, образуя этанол или другие продукты с высокой добавкой водорода.
Это лишь некоторые из химических реакций, которые происходят с этиленом и этаном. С их помощью можно различить эти два углеводорода и определить, с каким из них имеется дело.
Топ вопросов за вчера в категории образование
Образование 28.10.2023 10:34 1892 Угланова Яна.
Как решить: Для перевозки груза потребовалось 24 машины грузоподъём. 7,5 т?
Ответов: 1
Образование 02.09.2023 05:24 1198 Салымгереев Акылбек.
Как правильно: по получении или по получению?
Ответов: 1
Образование 26.09.2023 09:48 1307 Сапроненков Евгений.
Какое проверочное слово к слову “облегчить” (облегчение)?
Ответов: 1
Образование 26.08.2023 14:06 2074 Пинчук Никита.
Какие фрукты начинаются на букву “Р”?
Ответов: 1
Образование 06.09.2023 11:36 1964 Петрина Макс.
Как пишется: “средне-техническое” или “средне техническое ” образование?
Ответов: 1
Образование 07.11.2023 10:30 181 Ширяев Данил.
Какое проверочное слово к слову СОСТАВЛЯТЬ?
Ответов: 1
Образование 20.08.2023 17:20 640 Плотникова Юля.
Как правильно: “не подходит” или “неподходит”?
Ответов: 1
Образование 01.09.2023 05:01 1961 Зонова Виктория.
Какие фрукты начинаются на букву “Д”?
Ответов: 1
Образование 10.10.2023 17:31 573 Швецов Степан.
Какое проверочное слово к слову иссЯкать?
Ответов: 1
Образование 06.10.2023 16:43 742 Романов Ярослав.
Как правильно гулять” по лесу” или в” лесу”?
Ответов: 1
Тренировочные задания
1. Для метана верны следующие утверждения:
1) его молекула образована атомом углерода в sp-гибридном состоянии 2) это низкокипящая жидкость, хорошо растворимая в воде 3) это низкокипящий газ, плохо растворимый в воде 4) является основным компонентом природного газа 5) легко реагирует с разбавленной серной кислотой
2. Для метана верны следующие утверждения:
1) его молекула образована атомом углерода в состоянии sp2-гибридизации 2) метан реагирует с парами разбавленной азотной кислоты 3) метан обладает характерным неприятным запахом 4) сгорает на воздухе с образованием угарного газа и воды 5) сгорает на воздухе с образованием углекислого газа и воды.
3. Для этана верны следующие утверждения:
1) это бесцветный газ, немного легче воздуха 2) это бесцветный газ, немного тяжелее воздуха 3) при его взаимодействии с водой образуется этиловый спирт 4) при его дегидрировании образуется этилен 5) все атомы углерода в нём — третичные
4. Для этана верны следующие утверждения:
1) оба атома углерода в его молекуле являются первичными 2) не реагирует с гидроксидом натрия 3) реагирует с серной кислотой 4) реагирует с метаном 5) обладает резким неприятным запахом
5. Для этилена верны следующие утверждения:
1) оба атома углерода в его молекуле находятся в состоянии sp2-гибридизации 2) плотность паров этилена равна плотности паров азота 3) не реагирует с водой 4) не сгорает в кислороде 5) не присоединяет хлор
6. Для этилена верны следующие утверждения:
1) при нормальных условиях это легкокипящая жидкость, хорошо растворимая в воде 2) оба атома углерода в его молекуле находятся в состоянии sp3-гибридизации 3) взаимодействует с водой с образованием уксусной кислоты 4) взаимодействует с бромной водой с образованием 1,2-дибромэтана 5) взаимодействует с водой с образованием этилового спирта
7. Для ацетилена верны следующие утверждения:
1) при нормальных условиях это газ, пары которого легче воздуха 2) при нормальных условиях это газ, пары которого тяжелее воздуха 3) не реагирует с бромом 4) реагирует с водой с образованием этанола 5) реагирует с водой с образованием уксусного альдегида
8. Для ацетилена верны следующие утверждения:
1) атомы углерода в его молекуле находятся в состоянии sp2-гибридизации и соединены двойной связью 2) атомы углерода в его молекуле соединены тройной связью и находятся в состоянии sp-гибридизации 3) при его сгорании в кислороде образуется угарный газ и вода 4) при его сгорании в кислороде образуется углекислый газ и вода 5) реагирует с азотом
Химические свойства
Для различения этилена от этана можно использовать различные методы, включая масс-спектрометрию и спектроскопические методы. Масс-спектрометрия позволяет определить молекулярную массу вещества, анализировать его фрагменты и получить информацию о его структуре. Спектроскопические методы, такие как инфракрасная и УФ-видимая спектроскопия, позволяют исследовать колебания и переходы электронов в молекулах.
Колебания и переходы электронов в молекулах могут быть также исследованы с помощью спектроскопических методов, таких как колебательная и вращательная спектроскопия. Эти методы могут определить энергетические уровни молекулы и подтвердить ее структуру.
Хроматографическое разделение является другим полезным способом различения этилена и этана. Газохроматография – это процесс разделения смеси веществ на составляющие компоненты с использованием газообразной фазы и стационарной фазы, обычно на основе различий в их аффинности к этим фазам. Этот метод можно использовать для разделения и определения этилена и этана в смеси.
Окисление является другим важным химическим свойством, которое может помочь отличить этилен от этана. Этан неокисляем, тогда как этилен подвергается окислению под действием окислителя, например, хлора.
Взаимодействие с кислородом
Для отличия этилена от этана можно воспользоваться их различной способностью к взаимодействию с кислородом. Этилен обладает более высокой активностью и легко соединяется с молекулой кислорода.
Одним из методов анализа взаимодействия этилена с кислородом является использование техники масс-спектрометрии. Этот метод позволяет исследовать колебания и различительность масс вещества. С помощью масс-спектрометрии можно определить спектр вещества, который будет отличаться для этилена и этана.
Окисление этилена – процесс, которому подвергается этен при контакте с кислородом. Результатом окисления этилена является получение этиленоксида, который может быть обнаружен и идентифицирован с помощью хроматографического анализа. Хроматографическое исследование позволяет различать этилен и этан по их характеристикам и времени удерживания в колонке газохроматографа.
Взаимодействие с галогенами
Колебания масс-спектрометрии предоставляют информацию о структуре молекулы. Реакции с галогенами могут изменить массу молекулы и, следовательно, ее спектр масс.
Окисление этилена — это процесс, при котором вещество взаимодействует с кислородом. Окисление этана может произойти с образованием органических перекисей. Реакция окисления молекулы может быть проанализирована с помощью масс-спектрометрии или хроматографического спектра.
Для определения соотношения между различными галоидными производными можно использовать газохроматографию. Этот метод позволяет разделить компоненты смеси и определить относительные концентрации каждого компонента.
Таким образом, взаимодействие этилена с галогенами может быть изучено с использованием различных методов анализа, таких как колебания масс-спектрометрии, окисление, хроматографическое разделение и др. Эти методы позволяют определить химическую структуру и свойства этилена и отличить его от этана.
Как отличить этилен от этана
Кроме того, этилен и этан могут быть различены по своим физическим свойствам. Этилен имеет ниже плотность и кипит при более низкой температуре, чем этан. Поэтому, если при определении плотности и кипения вещества наблюдается значение, характерное для этилена, то можно утверждать, что это именно он.
Важно также отметить, что специальные индикаторы и газохроматография также могут быть использованы для отличия этилена от этана. Тем не менее, анализ физических свойств и проведение химических реакций являются более доступными и простыми методами для определения этилена и этана
Знание различий между этиленом и этаном важно во многих областях, таких как химия, нефтехимия, фармацевтика и другие, где эти углеводороды находят свое применение. Понимание различий между этиленом и этаном позволяет лучше понять их свойства и использовать их в соответствии с нуждами и требованиями конкретной ситуации
Видео:ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать

Что такое этен
Этен является углеводородом, который состоит из двух атомов углерода и четырех атомов водорода. Химическая формула этена является C2ЧАС4, Два атома углерода связаны друг с другом через двойную связь. Следовательно, этен является ненасыщенным углеводородом. Два атома углерода являются sp2 гибридизовал. Молекулярная геометрия этена плоская.
Рисунок 2: Молекулярная структура этена
Молярная масса этена составляет около 28,05 г / моль. Температура плавления этена составляет -169,2оC. При комнатной температуре и атмосферном давлении этен представляет собой бесцветный газ с характерным запахом. Угол связи между связями этена составляет около 121,3о, Поскольку атомы углерода состоят из негибридизованных p-орбиталей, эти орбитали могут образовывать пи-связь между двумя атомами углерода. Эта двойная связь вызывает реакционную способность этена.
Общее название для этена этилен, Он используется в производстве полимерных материалов, таких как полиэтилен, путем полимеризации этенового мономера. Этилен также играет важную роль в растениях как гормон, который регулирует созревание плодов.
Использование в промышленности
- Этилен имеет широкий спектр применений в различных отраслях. Главное применение этилена — производство полимеров. Этилен используется для производства полиэтилена, из которого изготавливают бутылки, пленку, трубы и другие пластиковые изделия. Также этилен используется в производстве этиленгликоля, который применяется в текстильной промышленности и производстве автомобилей.
- Этан также имеет широкое применение в промышленности. Он используется в качестве топлива — главным образом, в виде природного газа. Этан используется для отопления и готовки, а также в качестве сырья для производства этилена. Этан также играет важную роль в производстве химических веществ, включая уксусную кислоту и оксиэтанол.
Использование этилена и этана в промышленности в значительной степени определяется их уникальными свойствами и возможностями. Они являются важными компонентами многих производственных процессов и играют важную роль в развитии различных отраслей промышленности.
Физические свойства основных углеводородов
Одним из самых простых и наиболее распространенных углеводородов является метан (CH4), который имеет всего один атом углерода. Метан — газ, который при нормальных условиях образует безцветную и беззапаховую субстанцию. Он обладает низкой плотностью и может гореть в воздухе.
Другой известный углеводород — этан (C2H6), который состоит из двух атомов углерода. Этан также является газообразным веществом при нормальных условиях. Он обладает более высокой плотностью по сравнению с метаном и может использоваться в качестве сжиженного газа.
Более сложные углеводороды, такие как пропан (C3H8) и бутан (C4H10), также являются газообразными при нормальных условиях. У них выше плотность по сравнению с метаном и этаном, и они могут быть использованы в качестве сжиженного газа.
С увеличением количества атомов углерода углеводороды становятся более тяжелыми и имеют более высокую температуру кипения. Например, пентан (C5H12) является жидкостью при нормальных условиях и имеет температуру кипения около 36 °C.
Более длинные углеводородные цепи, такие как гексан (C6H14) и октан (C8H18), являются жидкими при нормальных условиях и имеют более высокие температуры кипения.
Для углеводородов с еще большим количеством углеродных атомов, таких как декан (C10H22) и эйкозан (C20H42), температуры кипения выше 100 °C, и они являются плавкими твердыми веществами при нормальных условиях.
- Метан — газ, безцветный и беззапаховый;
- Этан — газ, применяется в качестве сжиженного газа;
- Пропан — газ, применяется в качестве сжиженного газа;
- Бутан — газ, применяется в качестве сжиженного газа;
- Пентан — жидкость, температура кипения около 36 °C;
- Гексан — жидкость, температура кипения выше пентана;
- Октан — жидкость, температура кипения выше гексана;
- Декан — твердое вещество, температура кипения выше 100 °C;
- Эйкозан — твердое вещество, температура кипения выше 100 °C.
Химические свойства этилена и этана
Химические свойства этилена и этана различаются из-за различной структуры и связей между атомами углерода.
1. Реактивность:
- Этилен обладает высокой реактивностью, так как содержит двойную связь между атомами углерода. Он способен вступать во множество реакций, включая аддиционные реакции, реакции с присоединением галогенов и реакции полимеризации.
- Этан обладает низкой реактивностью, так как содержит только одинарные связи между атомами углерода. Он не вступает в большинство реакций, таких как аддиционные реакции или реакции полимеризации.
2. Инертность:
- Этан является инертным газом и не реагирует с большинством химических веществ при комнатной температуре. Он используется как азотонасыщающий агент.
- Этилен, в отличие от этана, обладает высокой инертностью в отношении многих химических веществ, но при нагревании он может реагировать с некоторыми хлорсодержащими соединениями.
3. Горючесть:
- Этан является горючим газом, который может гореть с пламенем и выделять значительное количество тепла при сгорании.
- Этилен также является горючим газом, но его горение происходит с более жарким и красным пламенем, чем у этана.
В целом, этилен и этан имеют различные химические свойства из-за различного строения и реактивности, что делает их полезными для различных промышленных и научных приложений.