Таблетки
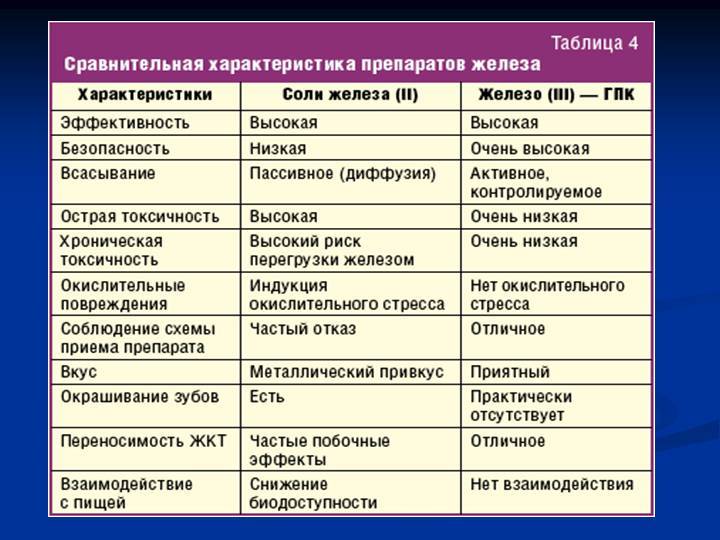
Если степень анемии легкая или средняя (гемоглобин не менее 70 г/л) и специальных противопоказаний к употреблению железа перорально нет, в первую очередь назначают лекарства, которые нужно глотать. Они могут быть как в таблетированной форме, так и в форме капсул, сиропа или раствора. Такой препарат содержит железо, которое всасывается в 15-20 раз эффективнее, чем из продуктов питания. Лекарства для перорального применения представлены в двух основных категориях:
- Различные соли железа(II): средство представляет собой соединение элемента с глюконовой, фумаровой, серной или соляной кислотой.
- Гидроксид полимальтозат железа(III), сокращенно ГПК – это самые лучшие препараты, которые работают быстрее, вызывают меньше побочных эффектов и не требовательны к времени употребления.
Врачи советуют рассчитывать дозу и другие параметры лечения индивидуально для каждого больного, но при этом продолжительность лечения при легкой степени должна составлять 3 месяца, средней – 4,5 месяца, тяжелой – 6 месяцев. Лекарство пьют в полном объеме в течение всего срока, чтобы восполнить дефицит железа и затем поддерживать нужный уровень этого микроэлемента в организме. Даже если по анализам концентрация приходит в норму – это не повод снижать количество препарата.
В таблице 2 перечислены основные препараты железа для перорального применения, указанные в соответствующих клинических рекомендациях. При приеме нужно соблюдать несколько простых правил:
- Лекарство короткого действия употребляют не менее чем через 15-20 минут после еды, до нее или во время этого делать нельзя. Препараты пролонгированного действия (например, Сорбифер Дурулес) можно употреблять и до еды.
- Кальций мешает всасыванию железа, поэтому молочные продукты вместе с препаратами употреблять нельзя.
- Разжевывать (за исключением специальных жевательных драже) препарат нельзя, лекарство нужно проглотить и запить большим количеством воды.
Таблица 2.
| Препарат | Форма выпуска препарата | Содержание железа в препарате |
| Актиферрин | Капсулы | Fe2+: 34,5 мг в 1 капсуле |
| Актиферрин | Капли | Fe2+: 9,48 мг в 1 мл |
| Актиферрин | Сироп | Fe2+: 34 мг в 5 мл |
| Сорбифер Дурулес | Таблетки | Fe2+: 100 мг в 1 шт. |
| Мальтофер | Раствор | Fe3+: 50 мг в 1 мл раствора (20 капель) |
| Мальтофер, МальтоферФол | Жевательные таблетки | Fe3+: 100 мг в 1 шт. |
| Мальтофер | Сироп | Fe3+: 10 мг в 1 мл |
| Тардиферон | Таблетки | Fe2+: 80 мг в 1 шт. |
| Тотема | Раствор | Fe2+: 5 мг в 1 мл |
| Ферретаб комп. | Капсулы | Fe2+: 50 мг в 1 капсуле |
| Ферроплекс | Драже | Fe2+: 10 мг в 1 драже |
| Ферронал | Таблетки | Fe2+: 30 мг в 1 шт. |
| Ферлатум | Раствор | Fe2+: 40 мг в 15 мл |
| Фенюльс | Капсулы | Fe2+: 45 мг в 1 капсуле |
| Феррум Лек | Жевательные таблетки | Fe3+: 100 мг в 1 шт. |
| Феррум Лек | Сироп | Fe3+: 10 мг в 1 мл |
| Хеферол | Капсулы | Fe2+: 115 мг в капсуле |
Существует несколько основных показателей, по которым врачи определяют, что лечение помогает.
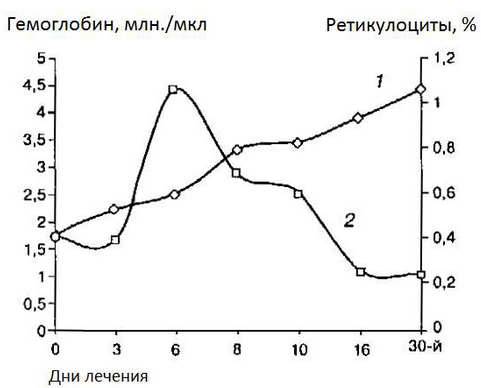
- Через 7-10 дней после начала употребления препарата количество ретикулоцитов (клеток – «предков» эритроцитов) увеличивается на 2-3%.
- Через 4 недели уровень гемоглобина возрастает на 10 г/л.
- Через 4-6 недель клинические проявления заболевания исчезают.
Побочные эффекты при пероральном приеме препаратов железа возникают редко. К ним относят: тошноту и рвоту, запоры и поносы, отсутствие аппетита, металлический привкус во рту. Пациенты также могут жаловаться на налет на зубах. Все это не повод прекращать употреблять средство.
Свойства и возможности магния
- Магний является одним из легчайших металлов и имеет низкую плотность.
- Он обладает высокой теплопроводностью и отличной электропроводностью.
- Магний обладает высокой прочностью и стойкостью к коррозии.
- Этот элемент является неотъемлемой частью многих сплавов, например, алюминиево-магниевых сплавов, которые обладают легкостью, прочностью и устойчивостью к коррозии.
- Магний является важным компонентом в производстве магниевых сплавов для применения в авиации, автомобилестроении, а также для создания спортивных и военных снарядов.
- Магний используется в производстве световых сплавов, которые обладают высокой яркостью и долгим сроком службы.
- Этот элемент применяется в процессе обработки стали, для удаления серы и фосфора.
- Магний является важным питательным микроэлементом, необходимым для нормального функционирования человеческого организма. Он участвует во многих биохимических процессах, включая работу сердца, нервной системы и мышц.
- Употребление продуктов, богатых магнием, таких как орехи, бобы, зеленые овощи и цельнозерновые продукты, способствует поддержанию здоровья и предотвращению различных заболеваний.
Это лишь несколько из множества свойств и возможностей магния, делающих его важным и неотъемлемым элементом в промышленности и жизни человека.
Ферромагнетизм и оксидация
Одним из факторов, влияющих на ферромагнетические свойства железа, является степень оксидации. Железо может существовать в двухвалентной и трехвалентной формах, в зависимости от количества электронов в его внешней оболочке.
Двухвалентное железо (Fe2+) имеет два свободных электрона во внешней оболочке, что делает его более легким для намагничивания и проявления ферромагнетизма. Это состояние железа встречается в некоторых соединениях, таких как FeO и FeS.
Трехвалентное железо (Fe3+) имеет только один свободный электрон во внешней оболочке, что делает его менее склонным к намагничиванию и обладание слабее выраженными ферромагнитными свойствами. Такие соединения железа широко встречаются в оксидах, сульфидах и других неорганических соединениях.
Стоит отметить, что оксидация железа может изменяться в различных условиях, что в свою очередь может влиять на его ферромагнитные свойства. Изменение степени оксидации может происходить в результате вступления металла в реакцию с кислородом или другими веществами.
Таким образом, степень оксидации играет важную роль в определении ферромагнетических свойств железа. Двухвалентное железо обладает более выраженным ферромагнетизмом, чем трехвалентное железо.
Свойства железа и его соединений
Железо — химический элемент восьмой группы, четвёртого периода, следовательно, строение его атома можно изобразить схемой:
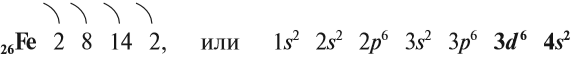
Железо — очень распространённый элемент периодической системы. Среди химических элементов, которые входят в состав Земной коры, оно занимает четвёртое место. В центре Земли имеется массивное железно-никелевое ядро, которое обеспечивает естественный магнетизм Земли.
Хотя атом железа в соединениях может проявлять степени окисления +2, +3, +6, в природе встречаются соединения преимущественно трёхвалентного железа:
- Fe2O3 — гематит (красный железняк);
- Fe2O3 · FeO — магнитный железняк;
- Fe2O3 · Н2О — бурый железняк.
Все эти руды имеют буро-красную окраску. Интересно, что от этой окраски произошло слово руда: «рудый» означает «рыжий». Дело в том, что железные руды встретились человеку давным-давно, и с освоения этих руд началась наша цивилизация, поскольку для разработки технологии выплавки железа из руды потребовались значительные интеллектуальные усилия, все знания, которых накопил человек.
Атомы железа (II) входят в состав гемоглобина крови. Именно эти атомы связывают кислород и транспортируют его по всем клеткам нашего организма. При этом атом железа становится трёхвалентным, с характерной для этого состояния «кровавой» окраской. Кстати, название руды «гематит» и означает «кровавый».
Железо — серебристо-белый пластичный металл. Это металл средней активности, тем не менее оно может реагировать с активными неметаллами (галогены, кислород, сера, углерод), кислотами, а при особых условиях — с водой. При этом если реакция происходит с сильным окислителем, то образуется соединение трёхвалентного железа. Впрочем, если в результате реакции образуется соединение двухвалентного железа, то на воздухе это соединение быстро окисляется до трёхвалентного состояния. Например, с сильным окислителем хлором образуется хлорид Fe (III):
А при взаимодействии с соляной кислотой, атом хлора которой может проявлять только восстановительные свойства, образуется хлорид железа (II).
Задание 11.1. Составить уравнение реакции взаимодействия железа с серой, водой, соляной кислотой, разбавленной азотной кислотой.
Соли железа (II) и (III) имеют разную окраску: растворы соединений железа (II) бесцветные, а растворы железа (III) — окрашены в жёлтый цвет.
При взаимодействии с щелочами из растворов солей железа можно получить его гидроксиды. Они так сильно отличаются друг от друга по цвету, что эту реакцию можно считать качественной на соединения железа с разной степенью окисления. Так, из солей Fe (II) выделяется белый (в инертной атмосфере) осадок, который на воздухе мгновенно зеленеет:
На воздухе этот осадок «ржавеет», становится буро-оранжевым. Состав полученного осадка очень близок к составу ржавчины:
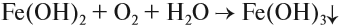
Наиболее чувствительной качественной реакцией на Fe3+ является реакция с роданидом калия:
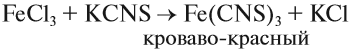
Оксид и гидроксид железа (II) проявляют основные свойства, т. е. реагируют с кислотами, но не реагируют со щелочами. В отличие от них, оксид и гидроксид железа (III) проявляют слабые амфотерные свойства. Это означает, что при обычных условиях эти вещества реагируют с кислотами и не реагируют со щелочами, но при сплавлении они со щелочами реагируют:
Кроме того, они растворяются в горячих, концентрированных растворах щелочей.
Таким образом, на примере свойств соединений железа ещё раз убеждаемся в справедливости закономерности: при возрастании степени окисления атома металла усиливаются и кислотные, и окислительные свойства соединений.
Действительно, для соединений двухвалентного железа характерны восстановительные свойства: они окисляются просто на воздухе. Для соединений трёхвалентного железа характерны окислительные свойства, они могут находиться в растворе длительное время. Единственное, что «угрожает» солям трёхвалентного железа, — гидролиз, поскольку эти соли соответствуют более слабому основанию.
Задание 11.2. Составьте уравнение реакции гидролиза хлорида железа (III).

Самое важное, что нужно сделать пред лечением ЖДА – это установить причинную связь с тем или иным фактором ее развития.
Во-первых, для того, чтобы определиться с формой лекарственного препарата, применяемого в лечении. Например, если нарушено всасывание железа, то нужно будет применять инъекционные способы восполнения дефицита железа.
Во-вторых, определение причины в некоторых случаях будет требовать дополнительных методов лечения, направленных на устранение потери железа с кровью, улучшение его всасывания из кишечника. Например, устранение мелких кровотечений из эрозий и язв ЖКТ. Лечение воспалительных заболеваний желудочно-кишечного тракта как причины плохого всасывания.
Как правило, если развилась эта анемия, то диеты с высоким содержанием железа в пище малоэффективны, так как нужно как можно быстрее восполнить дефицит железа, что сложно добиться одними лишь продуктами. К тому же мы не знаем точное содержание в них железа, чтобы ориентироваться на какие-либо объемы этой пищи. Поэтому большинстве случаев железодефицитную анемию начинают лечить таблетированными препаратами, содержащими соли двухвалентного железа (сульфат, фумарат, хлорид) и железосодержащие комплексы с трехвалентным железом, которые являются наиболее предпочтительными в лечении (см. таб.).
Ранее, когда не было таких препаратов железодефицитную анемию лечили путем потребления свежей животной крови, например, свиной. Люди приходили на бойни или мясные лавки и в день выпивали по стакану такой крови.
Дозировка приема железосодержащих препаратов (Fe++) устанавливается врачом в зависимости от степени тяжести. В среднем это 1 таблетка или капсула в сутки. В зависимости от производителя в состав таблетки могут добавляться различные полезные вещества фолиевая кислота (ферретаб, ферро-фольгамма), аскорбиновая кислота (сорбифер-дурулес, фенюльс, ферроплекс) и др. Что касается этой группы, то возможно развитие передозироовки, так как всасывание его неконтролируется. Поэтому лечение препаратами Fe++ должно проводиться строго под контролем как врачебным так и лабораторным.
По срокам препараты при микроцитарной железодефицитной анемии применяются примерно 1,5-2 мес. После нормализации уровня гемоглобина в крови применяются далее, но уже в половинной дозе в течение 4-6 недель.
Критерием эффективности лечение является такой показатель крови, как содержание ретикулоцитов в крови. При хорошем лечении их количество на 7-10 день резко увеличивается в 3-5 раз (до 10-15‰), что еще называют ретикулоцитарным кризом. Прирост гемоглобина начинается на 5 сутки если этого не произошло, то велика вероятность плохого усвоения препарата, использующегося при лечении ЖДА. Норма прироста в последующем на 1% или 0,15 г/л в сутки.
Если таблетированные формы железосодержащих препаратов плохо или совсем не переносятся, имеется необходимость очень быстро восполнить запасы железа в организме (например, при планировании срочного оперативного вмешательства), имеются воспалительные заболевания ЖКТ, такие как болезнь Крона, неспецифический язвенный колит и др., нарушающие всасывание этого микроэлемента из кишечника. Во всех вышеперечисленных случаях обычно переходят на прием парентеральных (инъекционных) средств для лечение железодефицитной анемии. К ним относятся ферковен, феринжект, мальтофер, железа III гидроксид сахарозный комплекс, космофер и др.
Лечение анемии должно проводиться под наблюдением врача. Подбор препаратов и дозу должен подбирать тоже врач. Не пытайтесь самостоятельно в домашних условиях ставить себе диагноз и начинать лечение – это может быть опасно для жизни. Так как поставить точный диагноз может только квалифицированный специалист, опираясь на лабораторные и инструментальные методы исследования.
Препараты железа при анемии (Таблица 1)
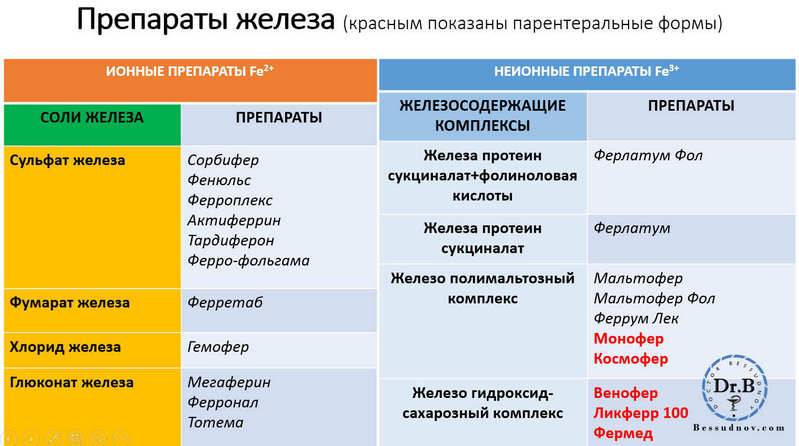
Существуют 2-х и 3-х валентные железосодержащие препараты (Fe2+ и Fe3+).
Принципиальные отличия (Таблица 2)

Правила выбора препаратов железа
В терапии железодефицитной анемии врач учитывает особенности обмена железа в организме, условия усвоения, эффективные сочетания и форму введения.
- Доказано, что при внутримышечном введении препаратов эффективность лечения ниже, чем при приеме таблеток. Это подтверждает, что главный путь усвоения железа — через кишечник. Кроме того, чаще проявляются побочные свойства.
- В лекарственных средствах должна содержаться оптимальная доза чистого железа 80-160 мг (это соответствует 320 мг сульфатной соли), такое количество способно обеспечить терапевтический эффект. Превышение этой дозировки может привести к нежелательным эффектам.
- Таблетки нельзя разжевывать, лучше глотать целиком, запивать водой. Таблетированная форма имеет преимущество перед жидкими лекарствами.
- Применение комплексных витамино – минеральных средств в данном случае не обладает необходимой эффективностью, слишком мала дозировка.
- Выбирая препараты, следует знать, что они могут содержать железо в двухвалентной и трехвалентной форме. Для усвоения двухвалентного железа нужен витамин С, а трехвалентного — особые аминокислоты, которые способны донести ионы до костного мозга.
- Преимущества отдаются капсулированным препаратам, покрытым защитной оболочкой. Они защищают слизистую пищевода и желудка от раздражающего воздействия.
Влияние на физические и химические свойства соединений
Железо двухвалентное и трехвалентное имеют различные физические и химические свойства, которые определяют их поведение в различных средах.
Первое отличие между ними заключается в их способности образовывать соединения с другими элементами. Железо двухвалентное обычно образует ионы с двумя электронами, что делает их более реактивными и склонными к участию в химических реакциях. В то же время, железо трехвалентное может образовывать ионы с тремя электронами, что делает его менее реактивным и более стабильным.
Другое отличие заключается в растворимости соединений железа. Железо двухвалентное чаще образует растворимые соединения, что делает его доступным для различных химических процессов. Железо трехвалентное, с другой стороны, часто образует нерастворимые соединения, и его применение может быть ограничено.
Важным фактором, влияющим на свойства соединений железа, является их оксидно-восстановительный потенциал. Железо двухвалентное имеет более высокий оксидно-восстановительный потенциал, что делает его хорошим восстановителем и способным участвовать в окислительно-восстановительных реакциях. Железо трехвалентное, с другой стороны, имеет более низкий оксидно-восстановительный потенциал и обычно действует в качестве окислителя.
Кроме того, железо двухвалентное и трехвалентное имеют разные химические реакции. Железо двухвалентное, например, может образовывать комплексные соединения с различными лигандами, такими как аминокислоты или органические соединения. Железо трехвалентное, с другой стороны, часто образует гидроксидные комплексы, которые имеют различные свойства и могут быть использованы, например, в процессах обезжелезивания.
Таким образом, различия в физических и химических свойствах между железом двухвалентным и трехвалентным играют важную роль в их поведении и могут иметь значительное влияние на использование этих соединений в различных областях науки и промышленности.
Применение железа и трехвалентных соединений
Железо и его трехвалентные соединения имеют широкий спектр применений в различных отраслях.
Металлургия:
Железо является основным компонентом стали, которая широко используется в строительстве, машиностроении и других отраслях промышленности. Трехвалентные соединения железа также применяются в процессах легирования стали, чтобы улучшить ее механические свойства и стойкость к коррозии.
Агрохимия:
Трехвалентные соединения железа используются в сельском хозяйстве в качестве удобрений, особенно для почв с низким содержанием железа. Они способствуют увеличению урожайности и улучшению качества растений.
Медицина:
Железо является важным элементом в организме человека и используется для синтеза гемоглобина и миоглобина. Некоторые трехвалентные соединения железа также применяются в лекарственных препаратах для лечения анемии и других заболеваний, связанных с дефицитом железа.
Электроника и магнетизм:
Железо используется в производстве различных электронных устройств и магнитов. Трехвалентные соединения железа также являются важными компонентами магнитных материалов, используемых, например, в динамиках и компьютерных жестких дисках.
Применение железа и трехвалентных соединений в различных отраслях подтверждает их важность и широкую функциональность
Значение и применение двухвалентного и трехвалентного железа в промышленности
Двухвалентное и трехвалентное железо играют важную роль в различных отраслях промышленности. Они имеют различные свойства и способы применения, что делает их незаменимыми материалами.
Двухвалентное железо
Двухвалентное железо (Fe2+) имеет две доступные валентности и встраивается в различные кристаллические структуры. Оно является основным компонентом в производстве большого количества материалов в различных отраслях:
- Производство стальных сплавов: двухвалентное железо является основным компонентом многих металлов, таких как сталь, чугун и нержавеющая сталь;
- Производство строительных материалов: двухвалентное железо используется в производстве цемента, который является одним из основных компонентов строительных материалов;
- Производство магнитов: двухвалентное железо используется для создания постоянных магнитов, которые широко применяются в различных устройствах;
- Производство химических соединений: двухвалентное железо является ключевым компонентом при производстве различных химических соединений, таких как красители, пигменты и лекарственные препараты.
Трехвалентное железо
Трехвалентное железо (Fe3+) имеет три доступные валентности и также широко используется в различных отраслях промышленности:
- Производство электроники: трехвалентное железо используется для создания различных электронных компонентов, таких как транзисторы, интегральные схемы и микросхемы;
- Производство красителей: трехвалентное железо является основным компонентом при создании различных красителей, которые используются в текстильной, пищевой и других отраслях;
- Производство аккумуляторов: трехвалентное железо широко используется в производстве заряжаемых аккумуляторов различных видов;
- Производство катализаторов: трехвалентное железо играет важную роль в процессе катализа и используется в производстве различных катализаторов;
- Производство медицинских препаратов: трехвалентное железо используется в производстве различных медицинских препаратов, таких как препараты для лечения анемии.
В итоге, двухвалентное и трехвалентное железо имеют широкое применение в различных отраслях промышленности. Их уникальные свойства делают их важными компонентами в создании различных материалов и продуктов, которые широко используются в повседневной жизни.
В чем разница между железом и железом?
Электронная конфигурация:
Электронная конфигурация железа:
1 с2, 2 с2, 2п6, 3 с2, 3п6, 4 с2, 3д6
Железо:
При образовании двухвалентного железа из атома железа удаляются два электрона (два 3s-электрона). Двухвалентное железо имеет шесть электронов в d-оболочке.
Fe → Fe2+ + 2e
Он имеет электронную конфигурацию 1 с2, 2 с2, 2п6, 3 с2, 3п6, 3д6.
Феррик:
Трехвалентное железо образуется при удалении трех электронов (двух 3s-электронов и одного d-электрона) из железа. Трехвалентное железо имеет пять электронов в d-оболочке. Это полузаполненное состояние на d-орбиталях, которое считается относительно стабильным. Следовательно, ионы трехвалентного железа относительно стабильны, чем ионы двухвалентного железа.
Fe → Fe3+ + 3e
Он имеет электронную конфигурацию 1 с2, 2 с2, 2п6, 3 с2, 3п6, 3д5.
Растворимость в воде:
Железо:
Когда ионы двухвалентного железа присутствуют в воде, образуется прозрачный бесцветный раствор. Потому что железное железо полностью растворяется в воде. Есть небольшое количество Fe2+ в естественных водных путях.
Феррик:
Его можно четко идентифицировать, когда трехвалентное железо (Fe3+) ионы присутствуют в воде. Потому что он производит красочные отложения с характерным для воды вкусом. Эти отложения образуются, поскольку ионы трехвалентного железа не растворяются в воде. Это довольно неприятно, когда ионы трехвалентного железа растворены в воде; люди не могут использовать воду, содержащую ионы трехвалентного железа.
Комплексное образование с водой:
Железо:
Ион железа образует комплекс с шестью молекулами воды; он называется ионом гексаакваирона (II) [Fe (H2O)6]2+(водн.). Он бледно-зеленого цвета.
Феррик:
Ион трехвалентного железа образует комплекс с шестью молекулами воды; его называют ионом гексаакваирона (III) [Fe (H2O)6]3+(водн.). Цвет бледно-фиолетовый.
Но мы обычно видим в воде тускло-желтый цвет; это связано с образованием другого гидрокомплекса, переносящего протоны в воду.
Что такое 3 валентное железо?
3 валентное железо, также называемое железо(III) или Fe(III), означает, что у атома железа в его ионном состоянии имеется 3 положительных заряда. Это означает, что атом железа потерял три электрона и имеет электронную конфигурацию 3d5. В этом состоянии 3 валентное железо обладает особенностями, которые делают его полезным в различных химических и физических процессах.
Одним из основных преимуществ 3 валентного железа является его способность к образованию стабильных соединений с различными анионами. Так, вода, оксиды, гидроксиды, хлориды и другие неорганические соединения могут образовывать стабильные комплексы с Fe(III). Благодаря этим свойствам, Fe(III) используется в промышленности для производства различных химических соединений, а также в медицине для создания лекарств и добавок к пище.
Еще одним важным свойством 3 валентного железа является его активность в окислительно-восстановительных реакциях. Благодаря своей способности принимать и отдавать электроны, Fe(III) может участвовать в многих биологических процессах, таких как ферментативные реакции и дыхание. Это делает его важным для поддержания нормального функционирования живых организмов.
Также стоит отметить, что 3 валентное железо обладает высокой стойкостью к внешним воздействиям, таким как кислоты и щелочи
Это делает его устойчивым к окислению и коррозии, что особенно важно при его использовании в различных промышленных процессах
В заключение, 3 валентное железо представляет собой важный элемент, который широко применяется в различных областях благодаря своим специфическим химическим и физическим свойствам. Его способность образовывать стабильные соединения, участвовать в окислительно-восстановительных реакциях и быть устойчивым к воздействию окружающей среды делает его незаменимым материалом для многих процессов и приложений.
Получение железа (чугуна и стали)
Производство чугуна основано на восстановительных свойствах углерода. Чугун образуется в домнах, куда загружают смесь кокса и железной руды. В результате горения кокса образуется необходимое для реакции тепло и сильный восстановитель — угарный газ:
Впрочем, и кокс является прекрасным восстановителем:
Угарный газ является основным восстановителем доменного процесса, поскольку ввиду газообразного состояния имеет высокую реакционную способность, способен проникать в любую точку домны. Кроме того, он не образует цементита. Эти реакции восстановления происходят при температуре 450…700 °C:
Полученный углекислый газ, реагируя с избытком кокса, вновь превращается в угарный газ:
и процесс продолжается. Он происходит в верхней части домны. Выделяющееся в твёрдом виде железо опускается в нижнюю часть домны, контактирует с коксом, начинает плавиться, так как температура в этой части печи превышает 1300 °C. Кокс, образуя сплав с железом (чугун), понижает температуру плавления железа на 400°; одновременно с этим часть железа образует цементит:
Для предохранения расплавленного железа от окисления в исходную смесь добавляют флюсы. Это известняк, который является поставщиком углекислого газа и, всплывая на поверхность, образует защитную плёнку.
Полученный чугун содержит до 4,5 % углерода, он используется для получения стали. Цель переработки — удаление примесей углерода, фосфора, серы. Готовая сталь должна содержать 0,3…2 % углерода. Кроме того, в сталь вводят различные добавки, которые изменяют её свойства. Так, нержавеющая сталь содержит около 12 % хрома.
Сталь является основным сплавом машиностроения, но легко ржавеет, так как подвергается коррозии (см. урок 8.4).
Свойства Fe
Перед тем, как начать ознакомление со всеми соединениями железа, необходимо иметь представление о его физических и химических свойствах. Нельзя сказать, чтобы химические способности данного элемента выделялись среди ему подобных, но физические свойства обусловливают его ценность и уникальность.
Физические свойства
Железо -ковкий и довольно прочный металл серебристо-белого цвета. На воздухе поддается коррозии с появлением желто-оранжевого налета – ржавчины. В чистом кислороде железо горит, а в обычных условиях кристаллизуется.Если брать только чистое железо, то оно является мягким и пластичным.
Химические свойства
Fe является химически активным элементом и чаще всего играет роль восстановителя. Итак, рассмотрим основные химические взаимодействия различных веществ с данным элементом:
Реакции с неметаллами. При термическом воздействии вступает в реакции с кислородом, углеродом и галогенами, участвует в гидролизе (с температурой свыше 700 градусов).
Реакции с солями. Железо вытесняет из солей слабые металлы, то есть те, у которых меньше значение электронного потенциала.
Реакция с угарным газом. В ходе взаимодействия получаем пентакарбонил железа.
Реакции с кислотами
Уделим особое внимание:
- Железо с легкостью вступает в реакции с соляной и разбавленной серной кислотами, образуя на выходе водород и соответствующие соли.
- Также взаимодействует с концентрированной серной кислотой, но по иному механизму. Здесь происходит образование кислотного оксида, соли и воды.
- Удачно реагирует с разбавленной азотной кислотой, а в аналогичной кислоте высокой концентрации железо пассивируется. Оксидная пленка покрывает поверхность металла, вследствие чего замедляется процесс коррозии.
Теперь перейдем к детальному изучению способностей соединений железа.
Как правильно принимать железосодержащие препараты?
Лечение или профилактика малокровия с помощью железосодержащих препаратов имеет несколько общих правил. Соблюдая их, можно обеспечить эффективность лечения и пресечь проявление побочных эффектов:
Принимать препараты железа 3х валентного или 2-хвалетного железа запрещается параллельно с Левомицетином и Тетрациклином, так как они мешают организму нормально всасывать необходимый микроэлемент.
Для того, чтобы железосодержащие препараты не вызывали нарушения в пищеварительной системе, параллельно необходимо принимать ферментные препараты, например, Фестал.
Для того, чтобы железо усваивалось лучше, необходимо принимать лимонную или аскорбиновую кислоту, которые улучшат этот процесс
Стоит обратить внимание на витамины группы В, а также витамины С, А, Е, а также микроэлементы медь и кобальт. Все это благоприятным образом повлияет на процесс синтеза гемоглобина.
Прием трехвалентного железа и прием пищи не нужно совмещать
Прием препаратов необходимо осуществлять между перерывами приема пищи.
Принимать железосодержащие препараты стоит с небольших доз. Это позволит проверить, как реагирует организм на действующие вещества. Если возникнут проблемы, необходимо заменить препарат на другой. Дозировка постепенно увеличивается до тех пор, пока не будет найдена «золотая середина».
Для каждого пациента, который страдает от малокровия, железосодержащий препарат подбирается в индивидуальном порядке. Это же касается и составления самого курса.
Анемия лечится до двух месяцев. Дальше препарат необходимо принимать в качестве профилактики.
Длительность курса приема железосодержащего препарата зависит от того, насколько хорошо или плохо идет процесс улучшения синтеза гемоглобина. Согласно медицинской практике, показатели должны вернуться в норму уже спустя 8 недель с момента начала приема препаратов.
Двухвалентное железо: особенности и преимущества
Для полноценного усвоения железа организму необходимы особые условия – оно должно находиться в определенной валентности. Валентность – это степень окисления атома, которая влияет на его реакционную активность и способность связываться с другими элементами.
Двухвалентное железо, или железо в состоянии Fe2+, является одной из форм этого микроэлемента. Оно обладает несколькими особенностями и преимуществами перед другими формами железа.
Особенности двухвалентного железа:
- Лучшая растворимость. Двухвалентное железо более легко растворяется в желудочном соке, что способствует его лучшему усвоению организмом.
- Устойчивость к окислению. В состоянии Fe2+ железо менее подвержено окислительным процессам, чем в состоянии Fe3+.
- Улучшенная доступность для тканей. Двухвалентное железо более активно взаимодействует с транспортными белками, что облегчает его поступление в ткани.
Выбор формы железа для организма зависит от многих факторов, включая индивидуальные особенности и состояние здоровья. Однако, при отсутствии медицинских показаний, двухвалентное железо обладает определенными преимуществами, которые могут способствовать его лучшему усвоению и использованию организмом.
Ключевое различие – железо и железо
Железо – один из самых распространенных металлических элементов на Земле, а железо (Fe2+) и железа (Fe2+) представляют собой две формы окисления элементарного железа, между которыми существует разница, основанная на их электронной конфигурации: железо имеет степень окисления +2, а трехвалентное железо – степень окисления +3. Другими словами, это два стабильных иона от одного родительского элемента. В ключевое отличие между этими двумя ионами находится их электронная конфигурация. Ион двухвалентного железа образуется, удаляя 2d-электроны из атома железа, тогда как ион трехвалентного железа образуется путем удаления 3d-электронов из атома железа.. Это дает разные химические свойства, различия в кислотности, магнитных свойствах реакционной способности и разные цвета в химических комплексах и растворах.
Что такое 2 валентное железо?
Железо (Fe) является одним из самых распространенных элементов на Земле и является важным компонентом многих биологических систем и процессов. 2 валентное железо обладает свойствами, которые отличают его от других форм железа, таких как 3 валентное железо (Fe3+).
Ключевое свойство 2 валентного железа – его способность к окислению и восстановлению. Это означает, что оно может легко приобрести или утратить электроны в химических реакциях, что позволяет ему участвовать в различных процессах, таких как транспорт электронов внутри клетки.
Одним из наиболее широко известных примеров использования 2 валентного железа является его роль в гемоглобине – белке, который транспортирует кислород через кровь к тканям организма. 2 валентное железо входит в состав гема – органической группы, связанной с молекулой гемоглобина и способной удерживать и переносить молекулы кислорода.
Однако, 2 валентное железо имеет и свои недостатки. Чрезмерное наличие железа в организме может привести к накоплению свободных радикалов и образованию ограниченной активности цельных оболочек, с возможными негативными последствиями для здоровья
Поэтому важно достигать правильного баланса в организме и следить за уровнем 2 валентного железа