Настоящие преимущества использования аммиака
Чем нашатырный спирт отличается от аммиака – описание, фото, таблица
Оба вещества широко применяются в разных областях человеческой деятельности. Аммиак и нашатырный спирт (в обиходе нашатырь) часто считают синонимами, хотя это не так, о чем вам поведает любой химик. Постараемся рассказать, как просто понять разницу и отличие между нашатырным спиртом и аммиаком, не вдаваясь в научные подробности и сложные химические формулы.
История открытия веществ
Аммиак открыл в конце XVIII века (1774 г) британский естествоиспытатель, химик и философ Джозеф Пристли. Полученный им бесцветный газ (формула NH3), обладающий довольно резким запахом, изначально был назван «щелочным воздухом». Что интересно, ученые последующие 10 лет не могли определить химический состав аммиака. Это сделал в 1785 году француз Клод Луи Бертолле, известный ученый-химик, подаривший медицине и пиротехнике «бертолетову соль». Вскоре газ «щелочной воздух» получил то название, которое мы употребляем сейчас. Почему именно такое?
По одной из версий, это связано с именем Амона, древнеегипетского божества, покровителя воздуха и небесного пространства. Согласно легенде, во время обряда богослужения с поклонением Амону люди вдыхали нашатырь, который при нагреве и выделял аммиак.
Другая версия связана с североафриканским оазисом Аммона, располагавшемся на пересечении караванных путей. Поскольку в оазисе постоянно останавливались на отдых торговцы и путешественники, то скопление там вьючного живого «транспорта» было чрезмерным, как и естественных отправлений их жизнедеятельности. Понятно, что в условиях постоянной жары мочевина животных, нагреваясь, разлагалась и выделяла в воздух газ аммиак. Обе версии правдоподобны, но какая из них правильная, доподлинно неизвестно.

Области где применяются аммиак и нашатырный спирт
Аммиачное производство одно из важнейших в химической промышленности. Газ широко применяется в самых разных отраслях:
Интересный факт: существует единственный в своем роде аммиакопровод протяженностью около 2000 км для транспортировки этого газа. Проложен по маршруту «Тольятти-Одесса».

Нашатырный спирт не применяется столь масштабно. В основном его используют в медицине – как жидкость против обморока (подносят на ватке к носу, чтобы вернуть человека в сознание) или в составе антисептиков. Также нашатырь нашел применение в быту – с его помощью выводят сложные пятна с различных поверхностей и одежды, чистят стекло и зеркала, нашатырный спирт входит в состав многих эффективных средств для мытья окон.
Сравнение аммиака и нашатырного спирта, в чем разница

Обыватели считают, что нашатырный спирт – это просто растворенный в воде аммиак. Однако у химиков процесс получения нашатырного спирта из аммиака проходит в 2 этапа. Сначала из аммиака высвобождают гидрат аммония, а только потом этот гидрат растворяют в воде, чтобы получить вещество под названием «нашатырный спирт».
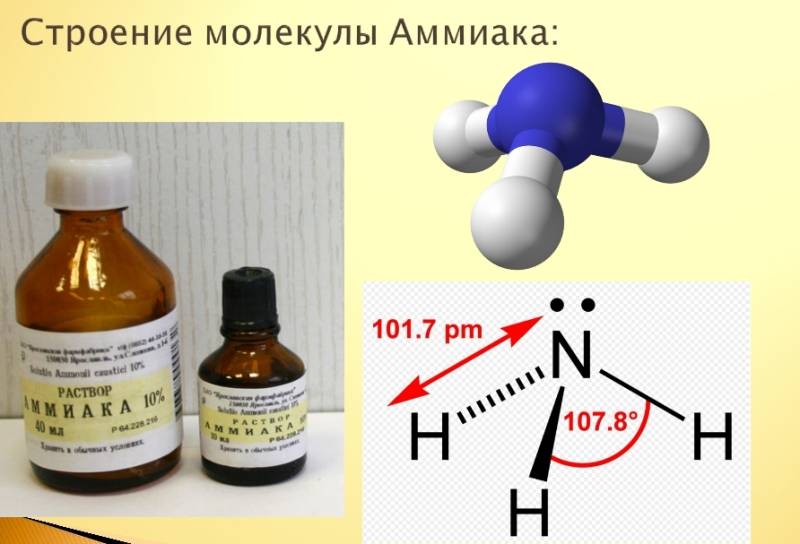
Химические свойства
- NH3 + H+ ⟶ NH4+.
Водный раствор аммиака («нашатырный спирт») имеет слабощелочную реакцию из-за протекания процесса:
- NH3 + H2O ⟶ NH4+ + OH− , Ko=1,8⋅10−5.
Взаимодействуя с кислотами, даёт соответствующие соли аммония:
- NH3 + HNO3 ⟶ NH4NO3.
аммиак также является очень слабой кислотой (в 10 000 000 000 раз более слабой, чем Вода), способен образовывать с металлами соли — амиды, имиды и нитриды. Соединения, содержащие ионы NH2−, называются амидами, NH2− — имидами, а N3− — нитридами. Амиды щелочных металлов получают, действуя на них аммиаком:
- 2NH3 + 2K ⟶ 2KNH2 + H2.
Амиды, имиды и нитриды ряда металлов образуются в результате некоторых реакций в среде жидкого аммиака. Нитриды можно получить нагреванием металлов в атмосфере азота.
Амиды металлов являются аналогами гидроксидов. Эта аналогия усиливается тем, что ионы OH− и NH2−, а также молекулы H2O и NH3 изоэлектронны. Амиды являются более сильными основаниями, чем гидроксиды, а следовательно, подвергаются в водных растворах необратимому гидролизу:
- NaNH2 + H2O ⟶ NaOH + NH3.
и в спиртах:
- KNH2 + C2H5OH ⟶ C2H5OK + NH3.
Подобно водным растворам щелочей, аммиачные растворы амидов хорошо проводят электрический ток, что обусловлено диссоциацией:
- KNH2 ⇄ K+ + NH2− .
Фенолфталеин в этих растворах окрашивается в малиновый цвет, при добавлении кислот происходит их нейтрализация. Растворимость амидов изменяется в такой же последовательности, что и растворимость гидроксидов: LiNH2 — нерастворим, NaNH2 — малорастворим, KNH2, RbNH2 и CsNH2 — хорошо растворимы.
При нагревании аммиак разлагается, проявляет восстановительные свойства. Так, он горит в атмосфере кислорода, образуя воду и азот. Окисление аммиака воздухом на платиновом катализаторе даёт оксиды азота, что используется в промышленности для получения азотной кислоты:
- 2NH3 →1200—1300∘C N2 + 3H2 (реакция обратима),
- 4NH3 + 3O2 ⟶ 2N2 + 6H2O (без катализатора, при повышенной температуре),
- 4NH3 + 5O2 ⟶ 4NO + 6H2O (в присутствии катализатора, при повышенной температуре).
На восстановительной способности NH3 основано применение нашатыря NH4Cl для очистки поверхности металла от оксидов при их пайке:
- 3CuO + 2NH4Cl ⟶ 3Cu + 3H2O + 2HCl + N2.
Окисляя аммиак гипохлоритом натрия в присутствии желатина, получают гидразин:
- 2NH3 + NaOCl ⟶ N2H4 + NaCl + H2O.
- Галогены (хлор, йод) образуют с аммиаком опасные взрывчатые вещества — галогениды азота (хлористый азот, иодистый азот).
- С галогеноалканами аммиак вступает в реакцию нуклеофильного присоединения, образуя замещённый ион аммония (способ получения аминов):
- NH3 + CH3Cl ⟶ [CH3NH3]Cl (гидрохлорид метиламмония).
- С карбоновыми кислотами, их ангидридами, галогенангидридами, эфирами и другими производными даёт амиды. С альдегидами и кетонами — основания Шиффа, которые возможно восстановить до соответствующих аминов (восстановительное аминирование).
- При 1000 °C аммиак реагирует с углём, образуя синильную кислоту HCN и частично разлагаясь на азот и водород. Также он может реагировать с метаном, образуя ту же самую синильную кислоту:
- 2CH4 + 2NH3 + 3O2 ⟶ 2HCN + 6H2O,
- NH4OH ⟶ NH3 + H2O.
- C солями меди и с серебром образует комплексные соли-аммиакаты
- Cu(NO3)2 + 4NH3 ⟶ [Cu(NH3)4](NO3)2,
- Cu3(PO4)2 + 12NH3 ⟶ [Cu(NH3)4]3(PO4)2,
- Cu(CH3CoO)2 + 4NH3 ⟶ [Cu(NH3)4](CH3CoO)2,
- AgNO3 + 2NH3 ⟶ [Ag(NH3)2]NO3.
Колонна синтеза аммиака, построенная в 1921 году BASF в Оппау, ныне расположена при университете Карлсруэ.
Применение нашатырного спирта в быту
Аммиачная вода используется в садоводстве, а также в быту, как универсальное чистящее средство. Ее используют в борьбе с тлей, для обработки культурных посадок на участке от луковой мухи и для подкормки растений. Используют аммиак (нашатырный спирт) следующим образом.
Рецепт №1 — от тли:
- 4 ст. л. препарата разводят в 20 л воды. Количество можно менять, исходя из такой концентрации под нужный объем.
- Добавьте в раствор немного стирального порошка (для лучшего прилипания).
- Используйте раствор для опрыскивания растений при борьбе с тлей.
Аммиак и нашатырный спирт — это отличные пятновыводители. Проверьте это прямо сейчас, следуя советам из предложенных статей
Рецепт №4 — чистка золота
- Смешайте 2 ч. л. нашатыря с 2 стаканами воды.
- Добавьте в раствор 1 ст. л. любого моющего средства.
- Поместите в чистящий раствор золотые украшения на 1-2 часа.
- После обработки, изделия промойте в воде и насухо протрите салфеткой.

Гидроксид аммония является важным источником азота для всех живых систем. В большом количестве азот имеется в атмосфере (больше 75%), но не многие живые существа способны использовать его, а ведь азот необходим для биосинтеза аминокислот, являющихся строительными блоками белка. Надеемся, что данная статья помогла вам оценить полезность, свойства и достоинства аммиака.
Многие медицинские средства могут использоваться как для лечебных, так и для хозяйственных целей, например, раствор нашатырного спирта часто применяют, чтобы уничтожить вредителей или для очистки мебельной обивки из кожи. Кроме того, таким веществом можно обрабатывать садовые растения, использовать для подкормки огурцов, а также при чистке серебра, золота, предметов сантехники.
Меры предосторожности
Используя гидроксид аммиака в медицине или для дома, необходимо соблюдать осторожность и применять индивидуальные средства защиты. Кроме того, надо следовать правилам:
- по возможности нанесение вещества на растения необходимо осуществлять в маске и резиновых перчатках;
- спирт нельзя смешивать с другими активными веществами;
- нельзя работать с препаратом людям, страдающим вегетососудистой дистонией;
- если неразведенный раствор попал внутрь, необходимо срочно выпить много воды, вызвать рвотный рефлекс и обратиться за помощью к врачу;
- хранить препарат нужно в закрытых местах;
- следует избегать попадания гидроксида аммиака на кожу лица;
- разводить состав следует на воздухе или на территории хорошо проветриваемого помещения.
История нашатырного спирта
Соль нашатырного спирта была известна римлянам с очень давних времен. Римляне собирали на территории древней Ливии залежи этого вещества возле храма Амуна.
Нашатырный спирт, как форма хлорида аммония, имел огромное значение для мусульманских алхимиков еще в 8 столетии. Впервые упоминание об этом веществе встречается в трактатах арабского химика Джабир ибн Хайяна, а также в работах европейских алхимиков 13 века — когда данный элемент упомянул Альберт Великий.
Использовали нашатырный спирт не только для определенных обрядов, но и для изменения оттенка красителей на растительной основе. Василий Валентин в 15 веке доказал, что получить NH4Cl можно и при воздействии щелочных веществ на хлорид аммония.
Немного позже хлорид аммония стали получать путем дистилляции рогов и копыт крупного рогатого скота (волов), а нейтрализация полученного карбоната осуществлялась соляной кислотой. За счет этого средство стало назваться “духом оленьего рога”.
Что такое аммиак и нашатырный спирт?
Даже судя по истории возникновения, нашатырный спирт и аммиак — это 2 разных вещества. Самое главное отличие этих двух химических соединений — при одних и тех же условиях они имеют различное агрегатное состояние:
- нашатырный спирт — это жидкость;
- аммиак — газ, сжижение которого происходит при температуре -33 С.
Многие считают, что нашатырный спирт — это просто раствор аммиака в воде. Для бытовых нужд часто так его и получают, однако настоящий процесс образования нашатырного спирта из аммиака более длительный и имеет две ступени:
- Из аммиака образуется гидрат аммония.
- При растворении полученного гидрата с водой, образовывается именно тот состав, который и называется нашатырным спиртом.
Таким образом, мнение о том, что аммиак — это нашатырный спирт, ошибочно.

Различие этих 2 веществ не только в химических формулах, но и в областях применения. Аммиак является одним из важнейших продуктов, используемых в химической промышленности. Этот газ нашел свое применение таким образом:
- Производство нашатырного спирта.
- Строительство (входит в состав противоморозных добавок).
- Производство полимеров, соды и азотной кислоты.
- Производство удобрений.
- Изготовление взрывчатых веществ.
- Применяется для поддержания стабильной работы различного бытового и промышленного оборудования как хладагент.
Применение
В основном используется для производства азотных удобрений (нитрат и Сульфат аммония, мочевина), взрывчатых веществ и полимеров, азотной кислоты, соды (по аммиачному методу) и других продуктов химической промышленности. Жидкий аммиак используют в качестве растворителя.
В холодильной технике используется в качестве холодильного агента (R717) (см. Аммиачная холодильная установка).
В медицине 10 % раствор аммиака, чаще называемый нашатырным спиртом, применяется при обморочных состояниях (для возбуждения дыхания), для стимуляции рвоты, а также наружно — невралгии, миозиты, укусах насекомых, для обработки рук хирурга. При неправильном применении может вызвать ожоги пищевода и желудка (в случае приёма неразведённого раствора), рефлекторную остановку дыхания (при вдыхании в высокой концентрации).
Применяют местно, ингаляционно и внутрь
Для возбуждения дыхания и выведения больного из обморочного состояния осторожно подносят небольшой кусок марли или ваты, смоченный нашатырным спиртом, к носу больного (на 0,5—1 с). Внутрь (только в разведении) для индукции рвоты
При укусах насекомых — в виде примочек; при невралгиях и миозитах — растирания аммиачным линиментом. В хирургической практике разводят в тёплой кипячёной воде и моют руки.
Поскольку аммиак является слабым основанием, при взаимодействии с кислотами он их нейтрализует.
Физиологическое действие нашатырного спирта обусловлено резким запахом аммиака, который раздражает специфические рецепторы слизистой оболочки носа и способствует возбуждению дыхательного и сосудодвигательного центров мозга, вызывая учащение дыхания и повышение артериального давления.
Нашатырный спирт: свойства и область применения
Нашатырный спирт – это раствор аммиачной соли в спирте. Он получается путем смешивания аммиака с этиловым спиртом. Эта смесь обладает рядом полезных свойств и широко применяется в различных областях.
Основное преимущество нашатырного спирта заключается в его антисептических и обезболивающих свойствах. Он обладает сильным антибактериальным действием, что делает его эффективным средством для обработки ран, порезов, ссадин и ожогов. Быстро останавливает кровотечение и снимает боль, способствуя быстрому заживлению ран.
Кроме того, нашатырный спирт обладает освежающим и охлаждающим эффектом. Он прекрасно снимает зуд и раздражение, поэтому может использоваться для облегчения состояния при укусах насекомых и ушибах. Также его часто применяют для снятия усталости ног и отеков.
Нашатырный спирт может быть полезен для профилактики грибковых заболеваний. Он эффективно борется с грибками на коже и ногтях, предотвращает их развитие и распространение. Для этого его рекомендуется наносить на пораженные участки несколько раз в день.
Также нашатырный спирт широко используется в медицине для профилактики и лечения простудных заболеваний. Он помогает справиться с насморком, а также обладает слабым муколитическим действием, способствуя откашливанию.
Область применения нашатырного спирта:
- расстройства кожи;
- насморк и простудные заболевания;
- ожоги, порезы и ссадины;
- грибковые инфекции;
- укусы насекомых;
- отеки и усталость ног.
Использование нашатырного спирта не рекомендуется в чистом виде, так как он может вызвать раздражение кожи. Рекомендуется разводить его водой в соотношении 1:3. Также перед использованием необходимо проконсультироваться с врачом или фармацевтом.
Сфера применения нашатырного спирта
Нашатырный спирт незаменим в медицине. Благодаря антисептическим свойствам он используется для обработки рук врачей и медицинских инструментов.
Регенерирующее и противоотечное действие вещества обуславливает его применение для заживления ран и ссадин.
Резкий запах спирта делает его средством номер один для быстрого вывода людей из обморочного состояния. Стоит человеку вдохнуть характерный аромат, как у него тут же поднимается давление и учащается дыхание, что мгновенно приводит к возвращению сознания.
Способность нашатырного спирта при употреблении внутрь вызывать рвоту также пригождается в определённых ситуациях.
Применение дешевое аптечное средство находит и в быту. Так, его часто используют для «подкормки» домашних цветов, ведь в составе спирта присутствует аммиак. Бонусом является отпугивающих насекомых резкий запах. При этом самим растениям никакого вреда не наносится, в отличии от использования иных, более агрессивных средств от мошек.
Домохозяйкам давно известна способность нашатырного спирта справляться с выведением пятен самого разного происхождения. Так же его водный раствор используется для обновления внешнего вида золотых и серебряных украшений, очистки хрусталя, окон и зеркал, удаления налета из раковин и ванных.
Что такое аммиак и нашатырный спирт?
Даже судя по истории возникновения, нашатырный спирт и аммиак — это 2 разных вещества. Самое главное отличие этих двух химических соединений — при одних и тех же условиях они имеют различное агрегатное состояние:
- нашатырный спирт — это жидкость;
- аммиак — газ, сжижение которого происходит при температуре -33 С.

Многие считают, что нашатырный спирт — это просто раствор аммиака в воде. Для бытовых нужд часто так его и получают, однако настоящий процесс образования нашатырного спирта из аммиака более длительный и имеет две ступени:
- Из аммиака образуется гидрат аммония.
- При растворении полученного гидрата с водой, образовывается именно тот состав, который и называется нашатырным спиртом.
Таким образом, мнение о том, что аммиак — это нашатырный спирт, ошибочно.

Различие этих 2 веществ не только в химических формулах, но и в областях применения. Аммиак является одним из важнейших продуктов, используемых в химической промышленности. Этот газ нашел свое применение таким образом:
- Производство нашатырного спирта.
- Строительство (входит в состав противоморозных добавок).
- Производство полимеров, соды и азотной кислоты.
- Производство удобрений.
- Изготовление взрывчатых веществ.
- Применяется для поддержания стабильной работы различного бытового и промышленного оборудования как хладагент.

Происхождение названия
аммиак (в европейских языках его название звучит как «аммониак») своим названием обязан оазису Аммона в Северной Африке, расположенному на перекрёстке караванных путей. В жарком климате мочевина (NH2)2CO, содержащаяся в продуктах жизнедеятельности животных, разлагается особенно быстро. Одним из продуктов разложения и является аммиак. По другим сведениям, аммиак получил своё название от древнеегипетского слова амониан. Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали минерал нашатырь (NH4Cl), который при нагревании испаряет аммиак.
Чем отличается аммиак от нашатырного спирта
Основным отличием NH4OH от нитрида водорода является их агрегатное первоначальное состояние. Аммиак – бесцветный газ, который сжижается при -33 градусах Цельсия. Нашатырный спирт – это жидкость, которую часто называют раствором аммиака. Различием веществ является и область их применения. Аммиак – основной продукт, используемый в химической промышленности. Этот газ часто берут:
- при производстве спирта;
- как хладагент для поддержания работы промышленных, бытовых систем;
- для производства удобрений, полимеров, азотной кислоты, соды;
- при строительстве;
- для изготовления взрывчатых веществ.
Моногидрат аммиака имеет более узкое использование, преимущественно как медицинский антисептик. Кроме того, раствор часто применяют домохозяйки для выведения пятен с одежды, для очищения золота и серебра, как подкорму для садовых и комнатных растений. Основным сходством этих средств считается то, что они способны неприятно пахнуть из-за большого содержания аммиачных солей.
История появления аммиака
Впервые аммиак получил в 1774 году английский химик Джозефом Пристли. Открытый им газ получил название “щелочного воздуха”, так как химический состав химик, а одновременно и священник, определить не смог. Лишь спустя 11 лет (в 1785 году) Клод Луи Бертолле — известный французский химик определил химический состав газа и назвал его аммиаком (NH3).
На счет того, почему газ назвали именно так, имеется две версии:
- одну связывают с именем бога древних египтян — Амоном;
- вторую — со сходным по звучанию оазиса в районе северной Африки — “Аммона”.
По первой версии, люди, поклоняющиеся богу Амону, во время обряда нюхали нашатырный спирт.
Согласно второй — в оазисе Аммона, который находится на перекрестке караванных путей, из-за нахождения огромного количества вьючных животных, скапливались продукты их жизнедеятельности. При условиях жаркого климата мочевина имеет свойство быстро разлагаться и выделять газ, названный аммиаком.
Какая из двух версий достоверная и правильная — неизвестно и по сей день.
Признаки отравления парами аммиака
К основным признакам отправления парами аммиака можно отнести кашель, одышку, ощущение тяжести в груди, спазм гортани. Нередко возникает возбужденное состояние, галлюцинации, тошнота и рвота, отек органов дыхания. В результате прямого контакта может возникнуть ожоговое поражение глаз, которое требует немедленной квалифицированной помощи. При попадании аммиачных растворов внутрь к вышеперечисленным признакам интоксикации следует добавить еще боли в пищеводе, кишечнике, желудке, диарею с кровью, снижение артериального давления. Указанное состояние опасно для жизни и требует немедленной квалифицированной помощи!
Применение в медицине
Аммиак является одним из осмогенов (новые фармацевтические приемлемые аминовые соли), которые человек может обнаружить по запаху. Сказать, что аммиак — это нашатырный спирт в корне не верно, ведь аммиак – это соединение водорода с азотом, а нашатырный спирт это химическое соединение аммиака с водой, в результате которого образуется гидрат аммиака. Существует водный бесцветный 10% раствор аммиака (нашатырный спирт) с резким запахом.
- Он применяется в медицине (10% и 25%) в качестве рвотного, антисептического, аналептического и раздражающего средства.
- Спирт используют для быстрого выхода из обморока и пробуждения ото сна.
Как применять средство? Несколько капель нанести на кусочек ткани, бинта, ваты и поднести к носу пострадавшего, не дотрагиваясь до него и подержать в течение 2-х мин.
Взять 1 ст. воды и добавить туда 5-6 капель спирта. Напоить им человека, получившего отравление алкоголем.
В отличие от традиционных способов, таких как вливание воды или растирание уха, метод позволяет очнуться и сформировать свои мысли так, чтобы ответить на вопросы, при этом выглядеть вполне трезвым.
Стерилизация игл
Нашатырный спирт может быть использован для стерилизации игл. Просто надо протереть ее ватным тампоном, смоченным в спирте или подержать иголку в течение нескольких секунд в бутылке с ним.
Снятие зуда
Если развести нашатырный спирт с водой в пропорциях 1:10, он избавляет от укусов слепней и комаров, снимает ожоги от крапивы и других растений.
НС и аммиак играют очень важную роль в промышленности и медицине.
При применении внутрь вызывает рвоту, что также является его полезным свойством в различных ситуациях. НС способен расширять сосуды, снижать напряженность мышц и влияет на работу сердца. Часто из НС делают различного вида примочки для того, чтобы ускорить заживление раны или чтобы уменьшить отеки. Также используется для обеззараживания ран или для дезинфекции рук у врачей.
Индия и Китай: отличительные особенности можно прочитать здесь
Так как нитрид водорода является ядовитым концентрированным составом, он может иметь серьезные побочные действия. К примеру:
- Нитрид водорода легко загорается на воздухе, что может привлечь к взрыву.
- Жидки аммиак оставляет ожоги. Это обосновано тем, что газ сжижается при низких температурах (-33 градуса).
- Пары нитрида водорода опасны для человека. Они могут поражать дыхательные пути и глаза.
Где применяется?
Нашатырный спирт нашёл широкое применение в медицине, в народных рецептах и быту.
В медицине
Принимают внутренне в строгой дозировке из-за риска отравления. Вдыхают пары для ингаляции, смазывают кожу или ногти.
В быту
Самая широкая отрасль применения – бытовая. С ним чистят серебро, санузел, моют окна, отстирывают пятна на ткани. Убирают пятна на обуви и мебели. Используют в борьбе с тараканами и муравьями в доме. Нашатырь справляется с неприятным запахом в холодильнике, препятствует появлению разводов после мытья на глянцевых, зеркальных и стеклянных поверхностях.
На даче
В качестве удобрения добавляют в воду для полива любого огородного растения. Резкий запах помогает избавиться вредителей: тля, долгоносики, медведка, мухи, муравьи.
Жидкий аммиак
Жидкий аммиак, хотя и в незначительной степени, диссоциирует на ионы (автопротолиз), в чём проявляется его сходство с водой:
- 2NH3 ⟶ NH4+ + NH2−.
Константа самоионизации жидкого аммиака при −50 °C составляет примерно 10−33 (моль/л)².
Жидкий аммиак, как и Вода, является сильным ионизирующим растворителем, в котором растворяется ряд активных металлов: щелочные, щёлочноземельные, Mg, Al, а также Eu и Yb. В отличие от воды с жидким аммиаком данные металлы не реагируют, а именно растворяются и могут быть выделены в исходном виде при испарении растворителя. Растворимость щелочных металлов в жидком NH3 составляет несколько десятков процентов. В жидком аммиаке NH3 также растворяются некоторые интерметаллиды, содержащие щелочные металлы, например, Na4Pb9.
Разбавленные растворы металлов в жидком аммиаке окрашены в синий цвет, концентрированные растворы имеют металлический блеск и похожи на бронзу. При испарении аммиака щелочные металлы выделяются в чистом виде, а щелочноземельные — в виде комплексов с аммиаком [Э(NH3)6], обладающих металлической проводимостью. При слабом нагревании эти комплексы разлагаются на металл и NH3.
Растворённый в NH3 металл постепенно реагирует с образованием амида:
- 2Na + 2NH3 ⟶ 2NaNH2 + H2 .
Получающиеся в результате реакции с аммиаком амиды металлов содержат отрицательный ион NH2−, который также образуется при самоионизации аммиака. Таким образом, амиды металлов являются аналогами гидроксидов. Скорость реакции возрастает при переходе от Li к Cs. Реакция значительно ускоряется в присутствии даже небольших примесей H2O.
Металлоаммиачные растворы обладают металлической проводимостью, в них происходит распад атомов металла на положительные ионы и сольватированные электроны, окружённые молекулами NH3. Металлоаммиачные растворы, в которых содержатся свободные электроны, являются сильнейшими восстановителями.