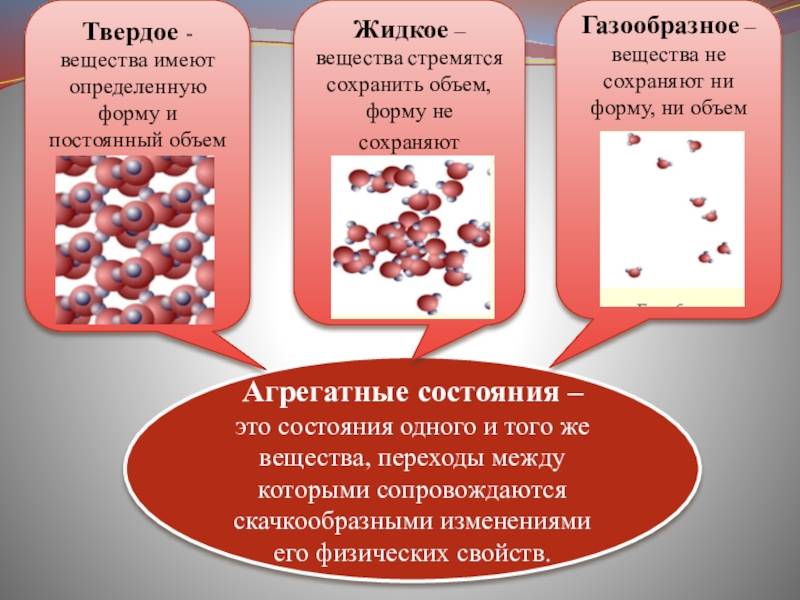
Вещества в твердом агрегатном состоянии
Твердые тела при обычных условиях сохраняют объем и форму. Например, песчинка, крупинка сахара, соли, кусок горной породы или металла. Если нагревать сахар, то вещество начинает плавиться, превращаясь в вязкую коричневую жидкость. Прекратим нагревание — снова получим твердое вещество. Значит, одно из главных условий перехода твердого тела в жидкость — его нагревание или повышение внутренней энергии частиц вещества. Твердое агрегатное состояние соли, которую используют в пищу, тоже можно изменить. Но чтобы расплавить поваренную соль, нужна более высокая температура, чем при нагревании сахара. Дело в том, что сахар состоит из молекул, а поваренная соль – из заряженных ионов, которые сильнее притягиваются друг к другу. Твердые вещества в жидком виде не сохраняют свою форму, потому что кристаллические решетки разрушаются.
Жидкое агрегатное состояние соли при расплавлении объясняется разрывом связи между ионами в кристаллах. Освобождаются заряженные частички, которые могут переносить электрические заряды. Расплавы солей проводят электричество, являются проводниками. В химической, металлургической и машиностроительной промышленности твердые вещества превращают в жидкие для получения из них новых соединений или придания им разной формы. Большое распространение получили сплавы металлов. Есть несколько способов их получения, связанных с изменениями агрегатного состояния твердого сырья.

Твердые и жидкие тела
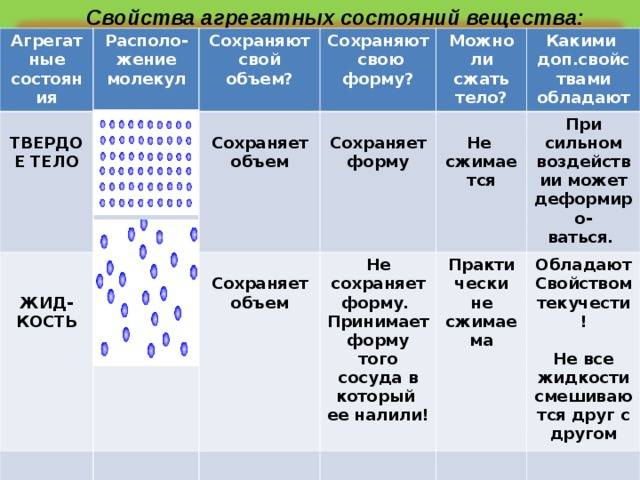
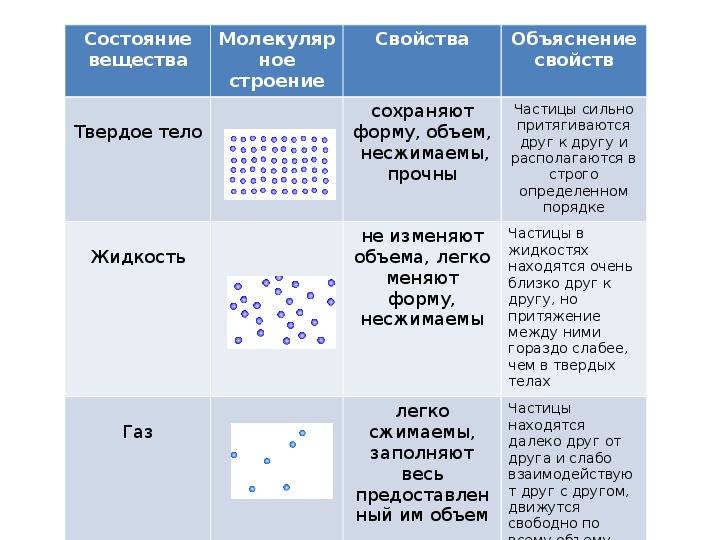
Твердые тела – это тела, которые отличаются постоянством своей формы и объема.
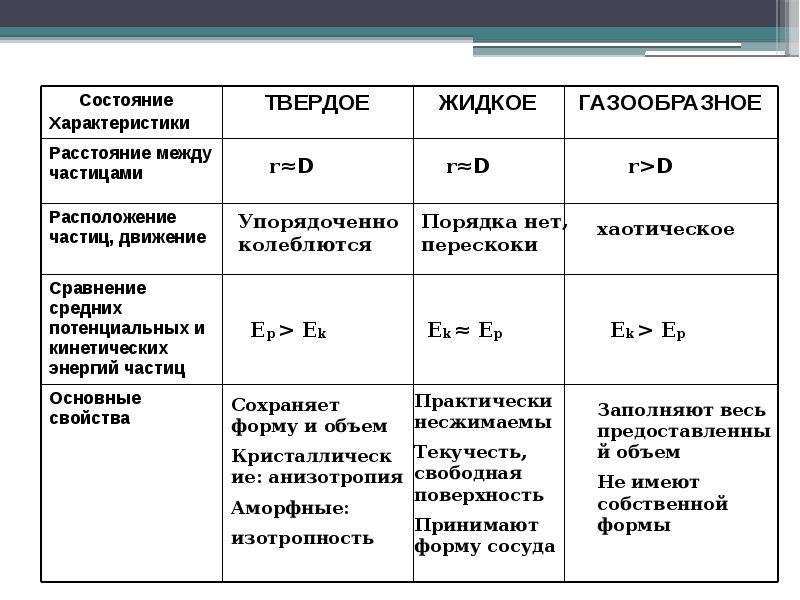
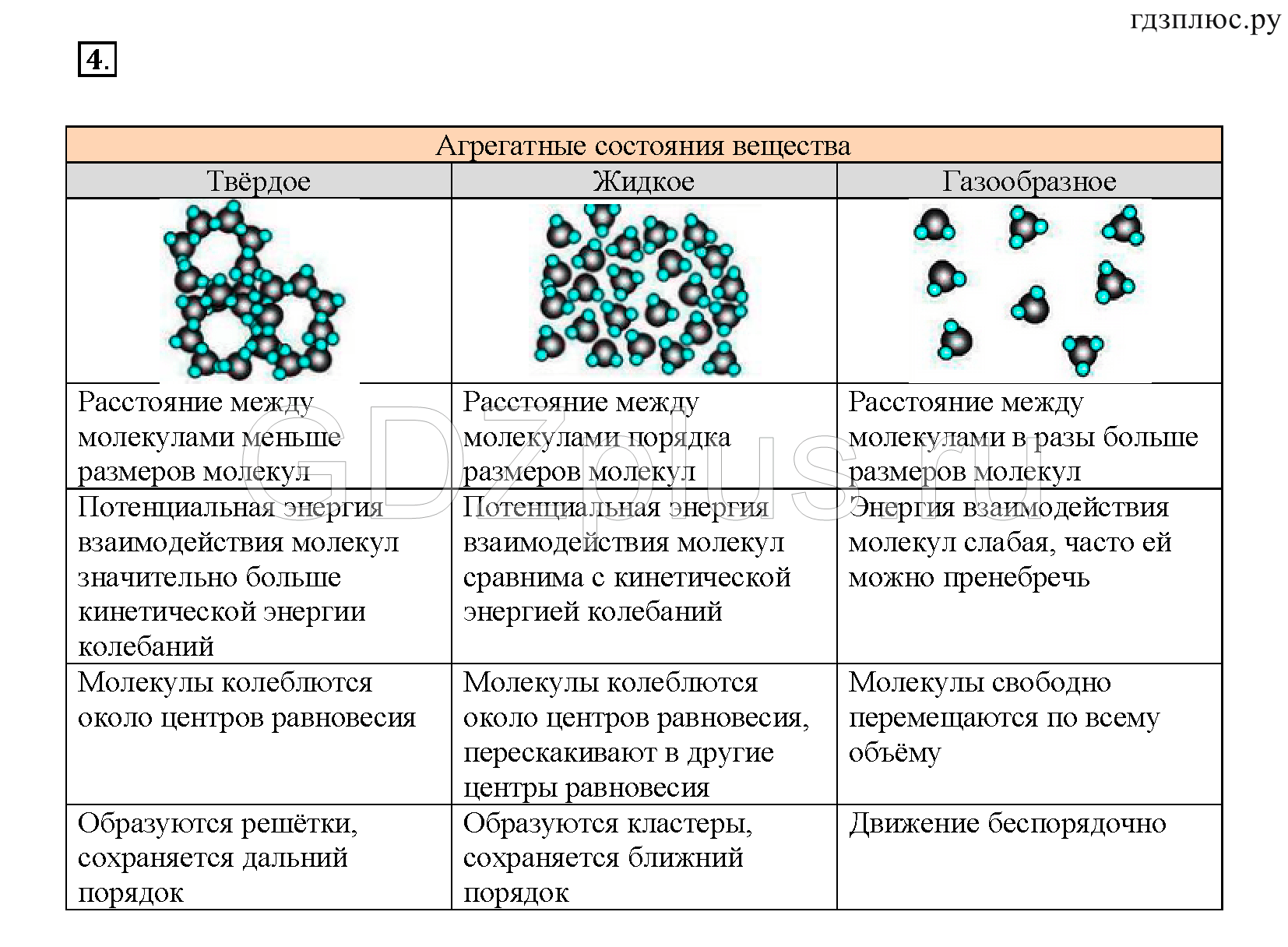
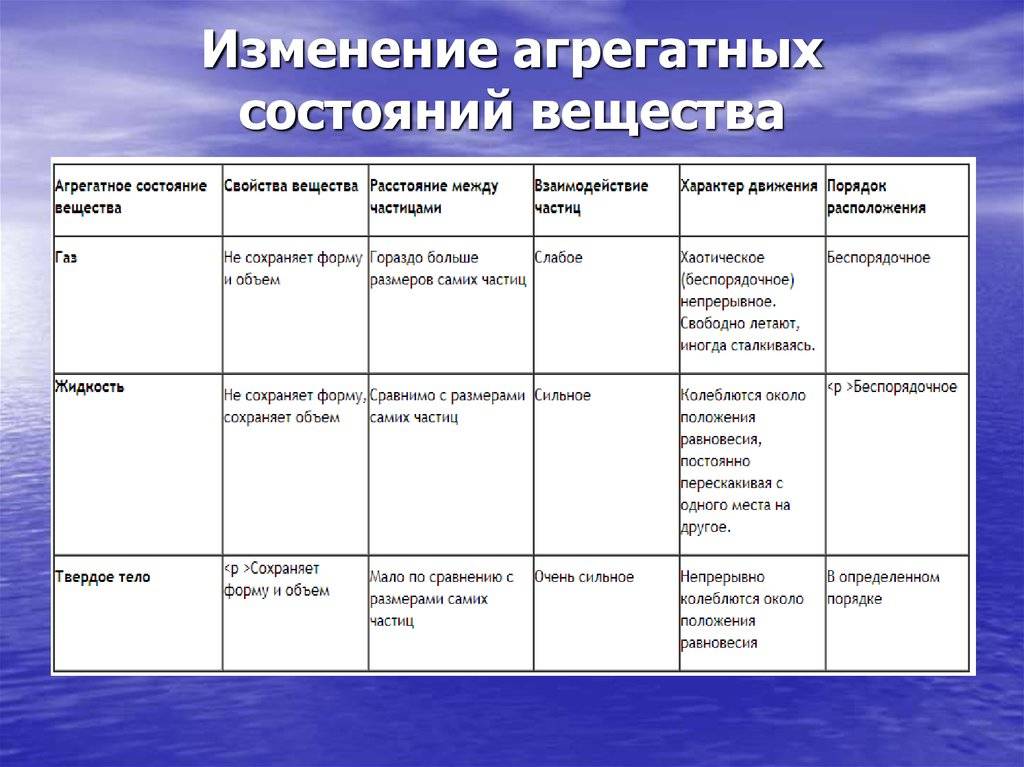
В твердых телах межмолекулярные расстояния маленькие, а потенциальную энергию молекул можно сравнить с кинетической.
Твёрдые тела подразделяются на 2 вида:
В состоянии термодинамического равновесия находятся только лишь кристаллические тела. Аморфные же тела по факту представляют собой метастабильные состояния, которые по строению схожи с неравновесными, медленно кристаллизующимися жидкостями. В аморфном теле происходит чересчур медленный процесс кристаллизации, процесс постепенного преобразования вещества в кристаллическую фазу. Разница кристалла от аморфного твердого тела состоит, в первую очередь, в анизотропии его свойств. Свойства кристаллического тела определяются в зависимости от направления в пространстве. Разнообразные процессы (например, теплопроводность, электропроводность, свет, звук) распространяются в разных направлениях твердого тела по-разному. А вот аморфные тела (например, стекло, смолы, пластмассы) изотропные, как и жидкости. Разница аморфных тел от жидкостей заключается лишь только в том, что последние текучие, в них не происходят статические деформации сдвига.
У кристаллических тел правильное молекулярное строение. Именно за счет правильного строения кристалл имеет анизотропные свойства. Правильное расположение атомов кристалла создает так называемую кристаллическую решетку. В разных направлениях месторасположение атомов в решетке различное, что и приводит к анизотропии. Атомы (ионы либо целые молекулы) в кристаллической решетке совершают беспорядочное колебательное движение возле средних положений, которые и рассматриваются в качестве узлов кристаллической решетки. Чем выше температура, тем выше энергия колебаний, а значит, и средняя амплитуда колебаний. В зависимости от амплитуды колебаний определяется размер кристалла. Увеличение амплитуды колебаний приводит к увеличению размеров тела. Таким образом, объясняется тепловое расширение твердых тел.
Жидкие тела – это тела, имеющие определенный объем, но не имеющие упругой формы.
Для вещества в жидком состоянии характерно сильное межмолекулярное взаимодействие и малая сжимаемость. Жидкость занимает промежуточное положение между твердым телом и газом. Жидкости, также как и газы, обладают изотpопными свойствами. Помимо этого, жидкость обладает свойством текучести. В ней, как и в газах, нет касательного напряжения (напряжения на сдвиг) тел. Жидкости тяжелые, то есть их удельные веса можно сравнить с удельными весами твердых тел. Вблизи температур кристаллизации их теплоемкости и прочие тепловые свойства близки к соответствующим свойствам твердых тел. В жидкостях наблюдается до заданной степени правильное расположение атомов, но только лишь в маленьких областях. Здесь атомы также проделывают колебательное движение около узлов квазикристаллической ячейки, однако в отличие от атомов твердого тела они периодически перескакивают от одного узла к другому. В итоге движение атомов будет весьма сложное: колебательное, но вместе с тем центр колебаний перемещается в пространстве.
Жидкости
В жидкости атомы или молекулы перемещаются в любых направлениях, хотя их отдельные свободные группы могут сцепляться на короткое время. Основное различие между жидким и твердым веществами состоит в том, что в первых атомы или молекулы не привязаны к какому-то определенному месту. Они свободно двигаются. Поэтому жидкость может легко течь. На текучести основано свойство жидкостей не образование своей формы, а занятие свободного пространства, в том числе и пустого сосуда. Его форму жидкость и принимает. Атомы любого вещества вообще похожи на крохотные шарики, перемещающиеся с разной степенью свободы.
Твердое агрегатное состояние
В твердых веществах за счет сильного взаимного притяжения у частиц нет возможности развивать необходимую кинетическую энергию и тем самым передвигаться свободно от заданной позиции при условии сохранения текущей температуры и давления. Частицы твердых веществ располагаются тесно друг от друга и образуют определенную структуру, которую называют кристаллической решеткой.
В твердом веществе молекулы плотно «упакованы». Как правило они образуют регулярную структуру, называемую кристаллической решеткой.
Эталонным примером регулярной кристаллической решетки является кристалл.
Более сложные состояния
Помимо основных состояний, в физике существуют и несколько более сложных фаз. Они делятся на следующие виды:
- низкотемпературные;
- высокоэнергетические;
- обусловленные большим давлением.
Низкотемпературные и высокоэнергетические
При температурах, близящихся к минимальному пределу, измеряемому менее, чем в миллионной доле Кельвина, у некоторых веществ проявляются особые способности. Например, жидкий гелий может протекать через узкие отверстия без трения. В таких условиях возникают новые агрегатные состояния, например:
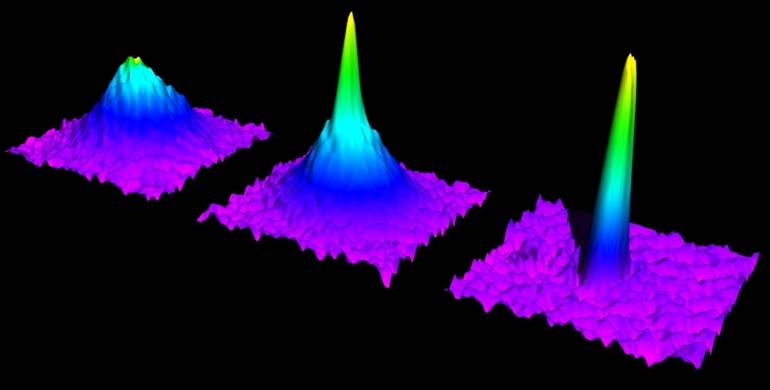
- Бозе-эйнтштейновский конденсат — вещество, состоящее в основном из бозонов, у которого квантовые эффекты можно наблюдать невооружённым глазом.
- Фермионный конденсат — сверхпроводимое вещество, в чей состав входят атомы-фермионы (к примеру, кварки, лептоны, дырки).
- Вырожденный газ — вещество с одинаковыми частицами, свойства которого определяются эффектами квантовой механики.
- Сверхтекучее твёрдое тело — кристалл, обладающий нулевой вязкостью и другими свойствами текучей жидкости.
Энергия столкновения микрообъектов может быть существенно выше, чем их массы. Физике известны 2 высокоэнергетических состояния со следующими характеристиками:
- Глазма — плотная система линейных связанных полей, образующаяся при высокоскоростных столкновениях адронов между собой.
- Кварк-глюонная плазма — разрушенная материя, породившая множество беспорядочно движущихся частиц (предполагается, что именно в виде такой плазмы вещество Вселенной состояло в первые мгновения своего расширения).
Другие фазы
При сверхвысоком давлении, сжатии силами гравитации и не очень большой температуре отрицательно заряженные частицы вещества объединяются с положительными, и оно принимает нейтронное состояние.
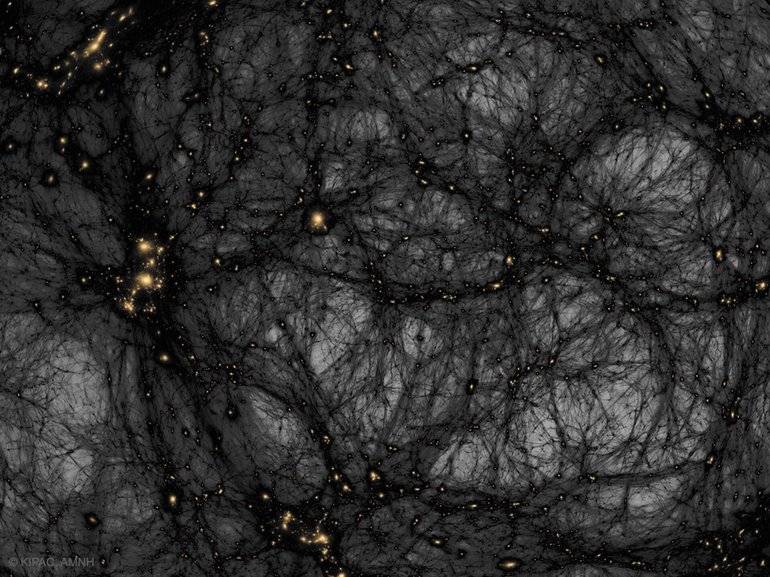
Ещё одной интересной формой вещества является тёмная материя, главная характеристика которой заключается в отсутствии испускания и взаимодействия с электромагнитным излучением. Из-за этого её непосредственное наблюдение, а также исследование природы и состава не представляется возможным, а существование обнаружено только благодаря имеющимся гравитационным эффектам.
Когда тело подвергают температуре и давлению выше конечной точки сосуществования фаз, оно превращается в сверхкритическую жидкость. В этом состоянии стирается разница между свойствами жидкого и газообразного веществ и приобретаются следующие характеристики:
- высокая плотность;
- низкая вязкость;
- неимение поверхностного натяжения.

Знать все состояния вещества человечество пока что не может. Это легко проиллюстрировать на примере вырожденной материи.
Идеальный газ Ферми-Дирака (вещество звёзд, относящихся к Белым карликам) при сверхвысоком давлении приобретает состав из одних нейтронов, а при поднятии температуры становится кварк-глюонной плазмой. При дальнейшем увеличении давления тело сжимается в чёрную дыру. Однако, что произойдёт с ним при одновременном повышении этих параметров и достижении планковской температуры, учёным до сих пор неизвестно.
Таким образом, физические свойства окружающих человека тел, а тем более космических объектов, не ограничиваются тремя или четырьмя агрегатными состояниями. Их гораздо больше, что открывает огромное поле для исследований.
Агрегатные состояния вещества
- Подробности
- Обновлено 17.08.2018 00:54
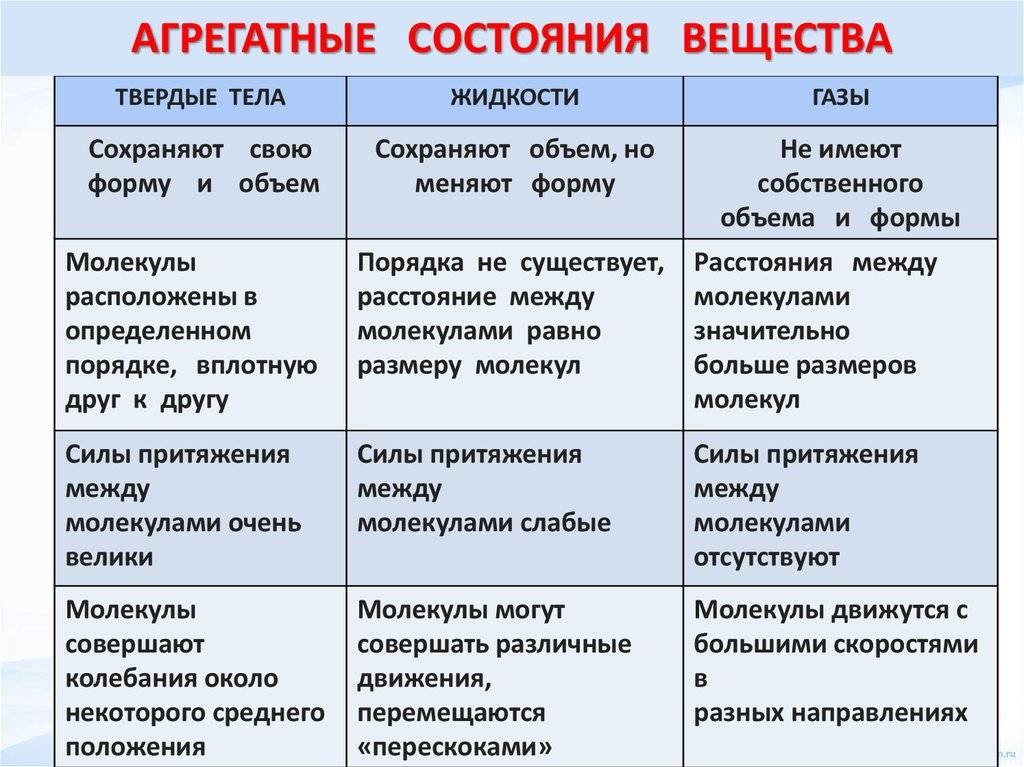
В зависимости от условий одно и то же вещество может находиться в различных агрегатных состояниях.
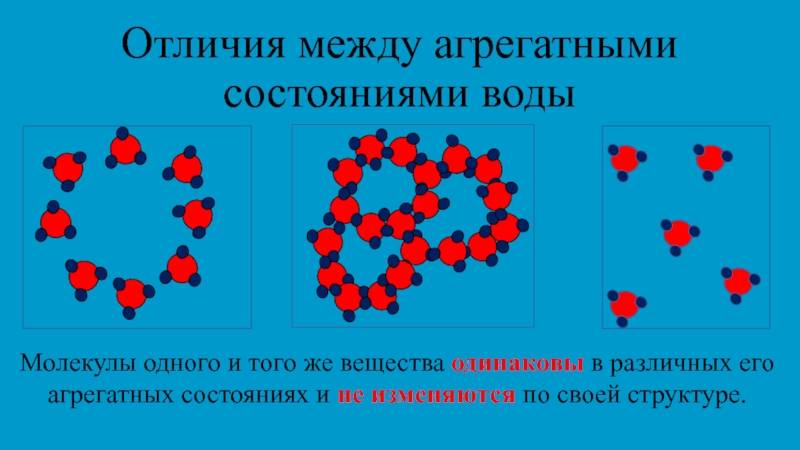
Молекулы вещества, находящегося в твердом, жидком или газообразном состоянии, не отличаются друг от друга.
Агрегатное состояние вещества определяется расположением, характером движения и взаимодействия молекул.
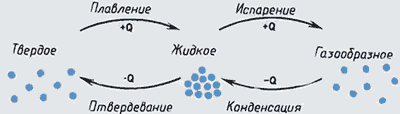
При повышении температуры вещества возможно перевести его сначала из твердого состояния в жидкое и при дальнейшем нагревании – в газообразное (пар).
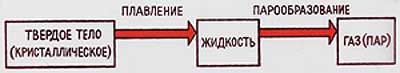
Процессы превращения твердого вещества в жидкое и жидкого в газообразное сопровождаются поглощением теплоты, т.к. для разрыва связей между частицами требуется дополнительная энергия.
В том агрегатном состоянии, где связи между частицами слабее, энергия их взаимодействия больше. Таким образом, поглощенная теплота идет на увеличение внутренней энергии вещества.

У одного и того же вещества:в твердом состоянии запас внутренней энергии меньше, чем в жидком состоянии; и запас внутренней энергии в жидком состоянии меньше, чем в газообразном (при неизменной массе).
При понижении температуры вещества в газообразном состоянии можно перевести его сначала в жидкое, а затем в твердое состояние.
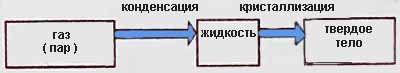
При этих превращениях вещества теплота выделяется.
Выделение теплоты сопровождается уменьшением внутренней энергии вещества.

Изменение агрегатных состояний и круговорот воды в природе
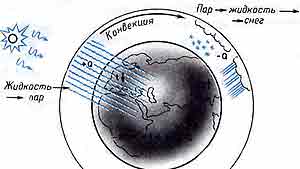
Солнечное тепло испаряет влагу с земной поверхности, конвективные потоки и диффузия позволяют парам достигнуть высоких атмосферных слоев. По мере движения вверх температура падает, пары конденсируются и образуются облака. Внутри облаков происходит формирование капель или снежинок и градин. Атмосферные осадки выпадают на землю в виде дождя или снега. В зависимости от времени года вода на земле может превратиться в лед, или наоборот, происходит таяние снега. На этом цикл замыкается.
Всё известное вещество на Земле и за ее пределами состоит из химических элементов. Общее количество встречающихся в природе химических элементов – 94. При нормальной температуре 2 из них находятся в жидком состоянии, 11 – в газообразном и 81 (включая 72 металла) – в твёрдом.
___
Жидкий воздух получили только в 1877 году под большим давлением, а гелий впервые был превращен в жидкость лишь в 1908 году.
ИНТЕРЕСНО
… из всех известных элементов в обычных условиях в жидком состоянии встречаются только два – ртуть и бром.
Следующая страница
Назад в раздел «8 класс»
Свойства веществ
Физические свойства — это любые характеристики вещества или предмета, которые могут быть измерены. Чаще всего, говоря о физических свойствах, мы подразумеваем массу, форму и объем. Масса — это количество вещества, форма — это внешние очертания, а объем — это пространство, которое занимает вещество. К физическим свойствам можно отнести цвет и запах вещества, а также его состояние при комнатной температуре.
 Различные цвета пламени во время горения солей марганцовки, медного купороса и поваренной соли
Различные цвета пламени во время горения солей марганцовки, медного купороса и поваренной соли
Кроме физических свойств все вещества обладают и химическими. Химические свойства характеризуют различные изменения состояния вещества при нагревании или смешивании его с другими веществами. Так, например, некоторые вещества растворяются в воде, меняют цвет при горении, взрываются в случае соединения с кислотами.
Области применения агрегатных состояний
Способность веществ переходить из одного агрегатного состояния в другой активно используется человеком. На ней основаны многие промышленные процессы.
- Способность металлов плавиться и принимать различную форму используется в черной и цветной металлургии.
- При получении соли и других химических соединений применяется выпаривание, при котором вещество получается после испарения жидкости.
- Инертные газы используются в осветительных приборах.
- Жидкий кислород применяется в медицине в качестве средства анестезии.
Таким образом, без различных агрегатных состояний невозможно было бы представить жизнь на планете. Фазовые переходы веществ используются практически во всех областях жизнедеятельности.
Свойства жидких веществ
Жидкое состояние вещества обладает рядом уникальных свойств, которые отличают его от газообразного и твердого состояний. Некоторые из основных свойств жидких веществ перечислены ниже:
1. Фиксированная форма и объем
В отличие от газообразного состояния, жидкое вещество имеет фиксированную форму, которая определяется формой сосуда, в котором оно находится. Однако жидкость может свободно менять свою форму под воздействием внешних сил. Жидкости также имеют определенный объем, который остается неизменным при изменении формы.
2. Поверхностное натяжение
Жидкие вещества обладают свойством поверхностного натяжения, которое проявляется в том, что их поверхность стремится принимать наименьшую площадь. Из-за этого свойства жидкости имеют способность капать или образовывать капли. Поверхностное натяжение обусловлено взаимодействием молекул жидкости между собой.
3. Вязкость
Вязкость – это свойство жидкости сопротивляться деформации и потоку. Она определяется внутренним трением между молекулами жидкости. Жидкости с высокой вязкостью, такие как мед или масло, текут медленно, тогда как жидкости с низкой вязкостью, такие как вода, текут быстро.
4. Растворимость
Жидкие вещества могут растворяться друг в друге и в твердых веществах. Растворимость зависит от химических свойств веществ и условий, таких как температура и давление. Растворение – это процесс, при котором молекулы одного вещества разбиваются на отдельные и перемешиваются с молекулами другого вещества, образуя гомогенную смесь.
Это лишь некоторые из основных свойств жидких веществ, которые делают их уникальными и отличающимися от газообразного и твердого состояний. Знание этих свойств позволяет понять и объяснить многие физические и химические явления, происходящие в жидкостях.
Любознательным
Следы на песке
Если свести почти вплотную большой и указательный пальцы, то между ними возникает темная линия.
Множество таких темных линий вы можете увидеть, если посмотрите между зубцами вилки, поворачивая ее при этом.
Чем объясняется появление этих темных линий? Будут ли изменяться расстояния между линиями в зависимости от угла поворота
вилки? Если да, то как?
Оказывается…
Темные линии между пальцами — это темные полосы интерференционной картины, возникающей при дифракции света
на щели между пальцами. Свет, проходящий через один участок щели (скажем, непосредственно рядом с пальцем),
ослабляется в результате интерференции со светом, проходящим через другой участок (лежащий чуть дальше от пальца),
и наблюдатель видит темную линию.
И это ещё не всё!
Сравнительная характеристика аморфных и кристаллических веществ
Вещество | Характеристика |
Аморфное | 1. 2. 3. 4. 5. Примеры: |
Кристаллическое | 1. 2. 3. 4. 5. Примеры: |
Кристаллические
вещества плавятся при строго определенной
температуре (Т пл),
аморфные – не имеют резко выраженной
температуры плавления; при нагревании
они размягчаются (характеризуются
интервалом размягчения) и переходят в
жидкое или вязкотекучие состояние.
Внутреннее строение аморфных веществ
характеризуется беспорядочным
расположением молекул.
Кристаллическое
состояние вещества предполагает
правильное расположение в пространстве
частиц, составляющих кристалл, и
образованием кристаллической
(пространственной
)
решетки.
Основной
особенностью кристаллических тел
является их анизотропия
–
неодинаковость свойств (тепло-,
электропроводность, механическая
прочность, скорость растворения и т.д.)
по разным направлениям, в то время как
аморфные тела изотропны
.
Твердые
кристаллы
– трехмерные образования, характеризующиеся
строгой повторяемостью одного и того
же элемента структуры (элементарной
ячейки) во всех
направлениях. Элементарная
ячейка
–
представляет собой наименьший объем
кристалла в виде параллелепипеда,
повторяющегося в кристалле бесконечное
число раз.
Основные
параметры кристаллической решетки
:
Энергия
кристаллической решетки (Е
кр.
,
кДж/моль) –
это
энергия, которая выделяется при
образовании 1 моль кристалла из микрочастиц
(атомов, молекул, ионов), находящихся в
газообразном состоянии и удаленных
друг от друга на расстояние, исключающее
их взаимодействие.
Константа
кристаллической решетки (
d
,
[
A
])
–
наименьшее
расстояние между центром двух частиц
в кристалле, соединенных химической
связью.
Координационное
число (к.ч.) –
число
частиц, окружающих в пространстве
центральную частицу, связанных с ней
химической связью.
Точки,
в которых размещены частицы кристалла,
называются узлами
кристаллической решетки
Несмотря
на многообразие форм кристаллов, их
можно классифицировать. Систематизация
форм кристаллов была введена А.
В.
Гадолиным
(1867 г.), она основана на особенностях их
симметрии. В соответствии с геометрической
формой кристаллов возможны следующие
их системы (сингонии): кубическая,
тетрагональная, орторомбическая,
моноклинная, триклинная, гексагональная
и ромбоэдрическая (рис. 18).
Одно
и то же вещество может иметь различные
кристаллические формы, которые отличаются
по внутреннему строению, а значит, и по
физико-химическим свойствам. Такое
явление называется полиморфизмом
.
Изоморфизм
–
два разных
по природе вещества образуют кристаллы
одинаковой структуры. Такие вещества
могут замещать друг друга в кристаллической
решетке, образуя смешанные кристаллы.
Рис.
18. Основные системы кристаллов.
В
зависимости от вида частиц, находящихся
в узлах кристаллической решетки и типа
связей между ними кристаллы бывают
четырех типов: ионные,
атомные, молекулярные и металлические
(рис.
19).
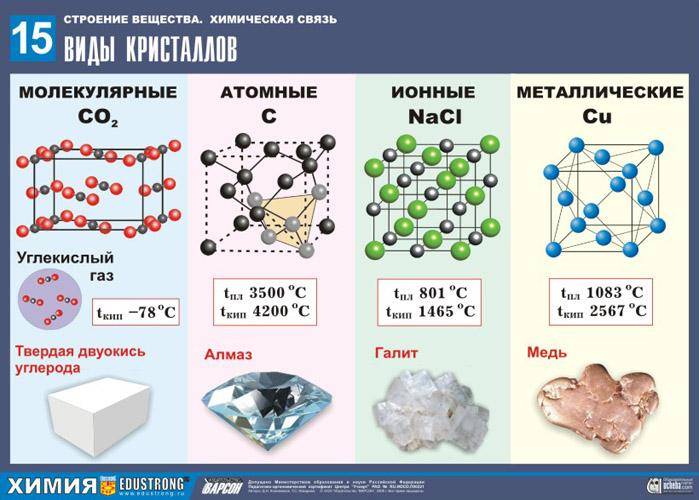
Рис.
19. Виды кристаллов
Характеристика
кристаллических решеток представлена
в табл. 34.
Агрегатные состояния вещества
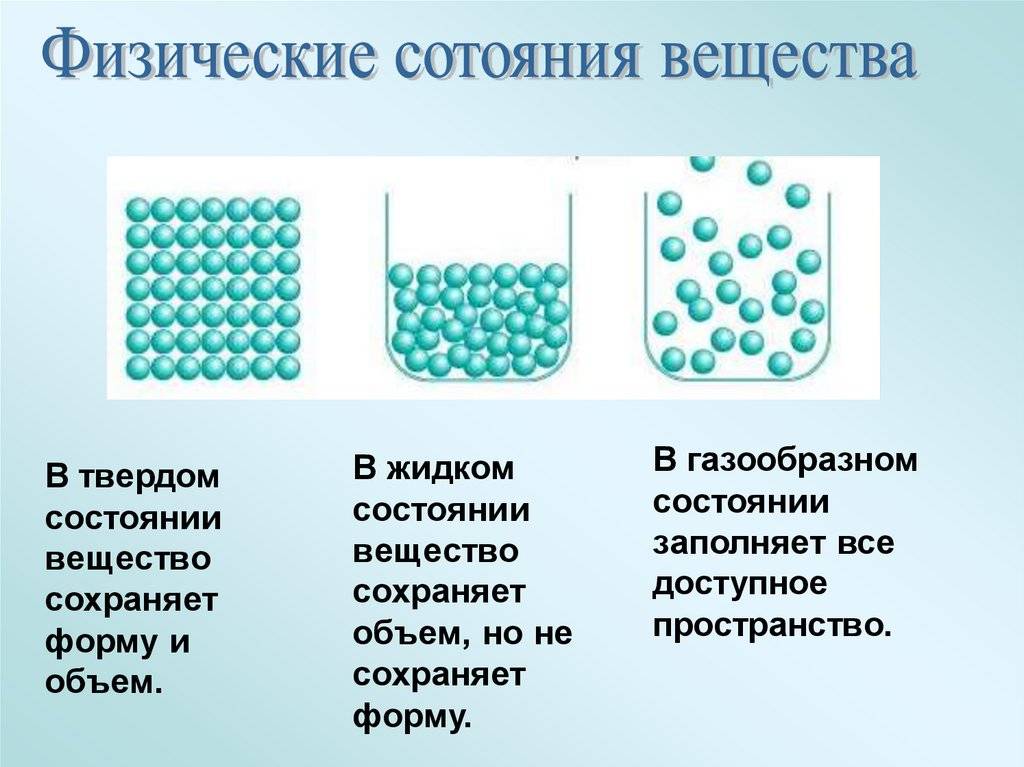
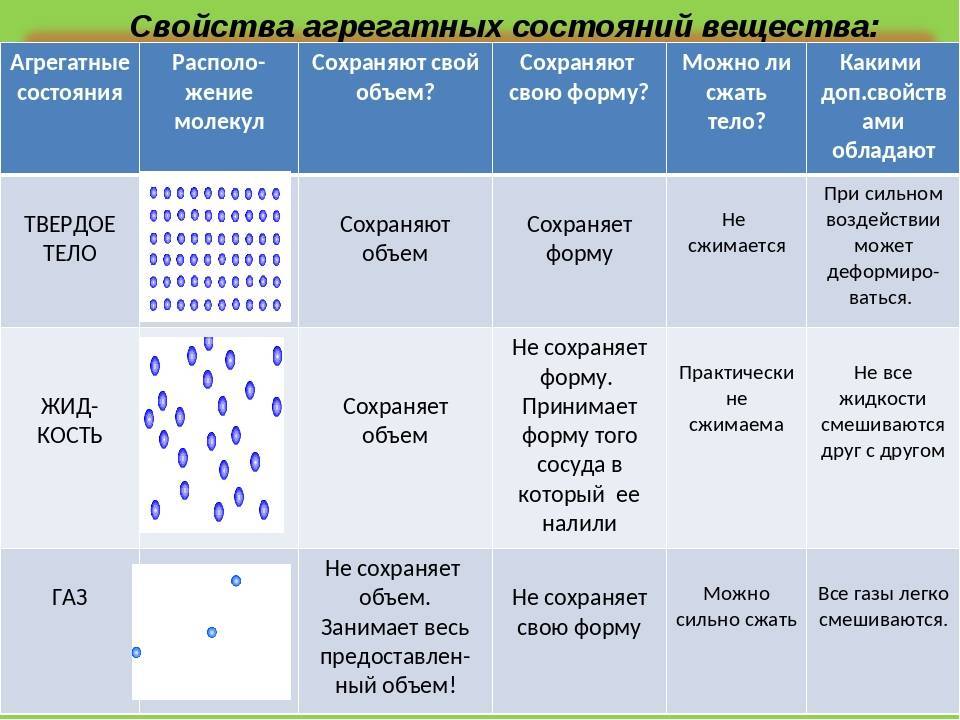
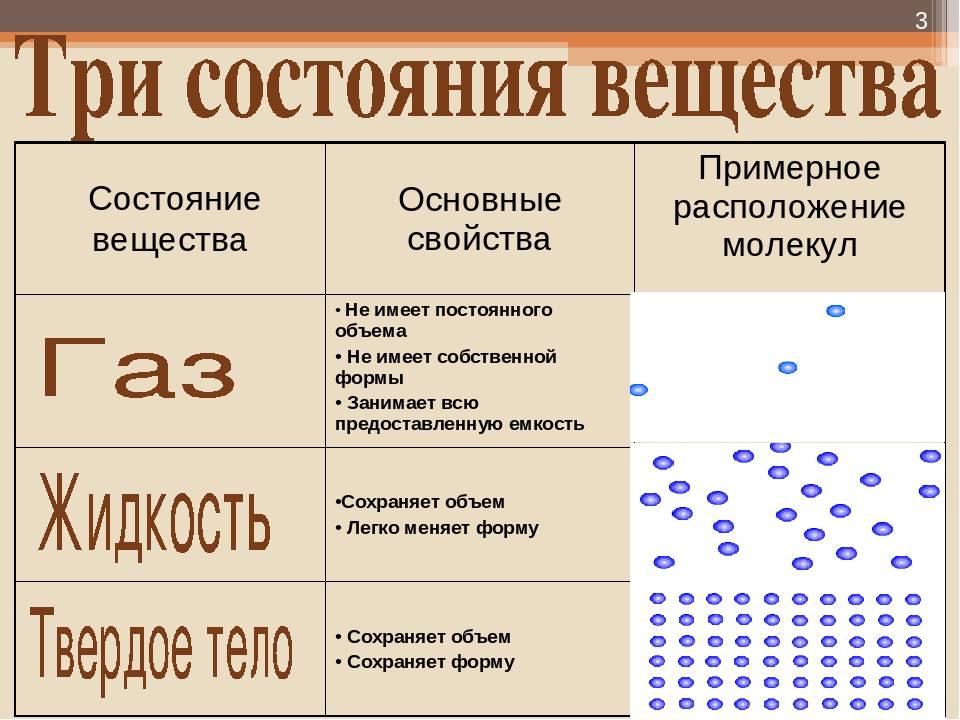
Все вещества в зависимости от условий могут находиться в трёх агрегатных состояниях: твёрдом, жидком и газообразном. Различные агрегатные состояния существуют у каждого вещества. Наглядным примером этому служат лёд, вода и водяной пар.
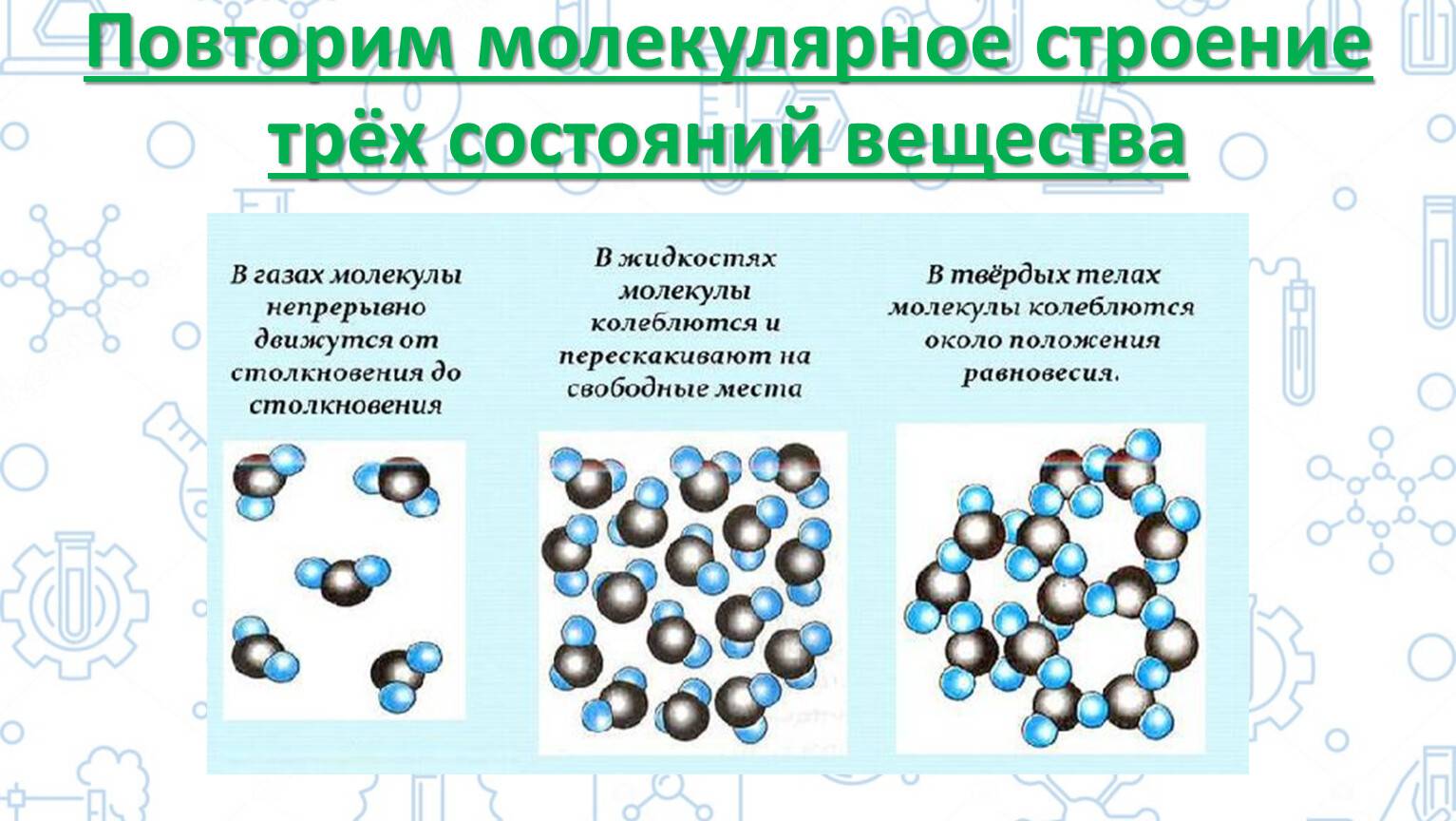
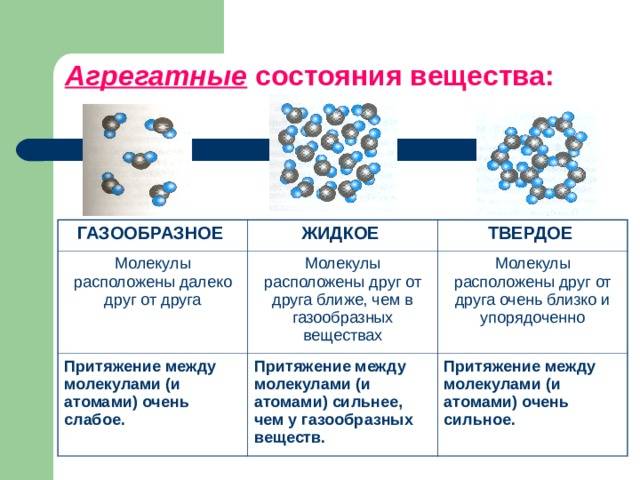
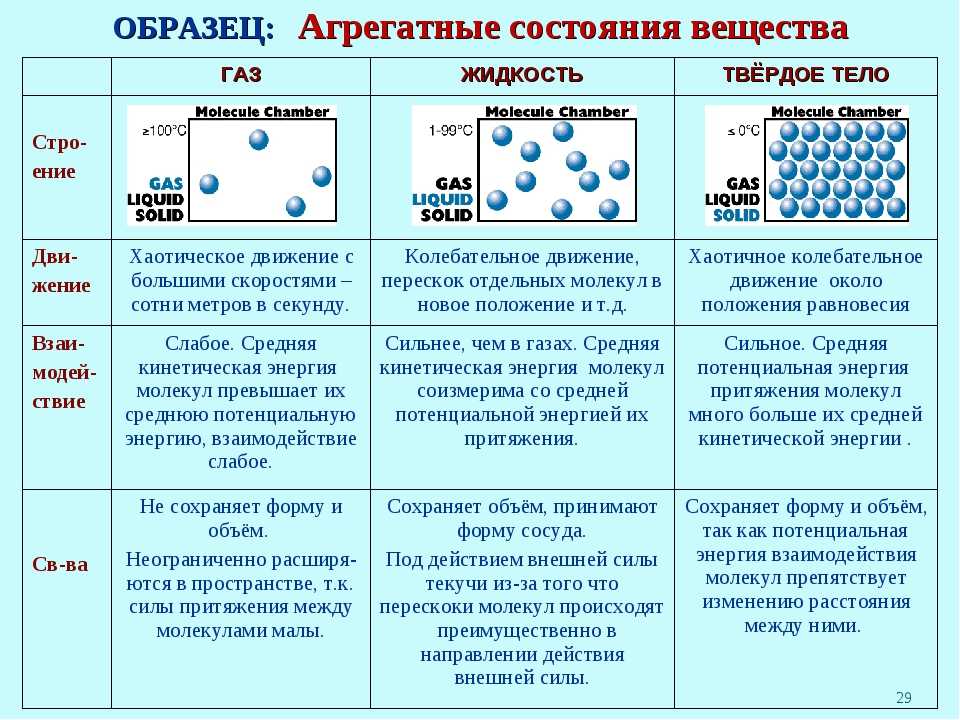
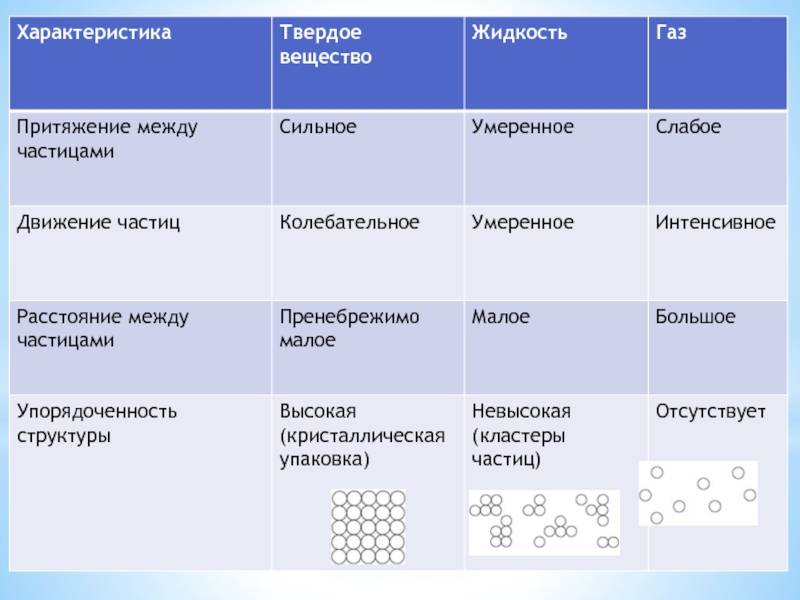
ЧЕМ ОПРЕДЕЛЯЕТСЯ АГРЕГАТНОЕ СОСТОЯНИЕ ВЕЩЕСТВА
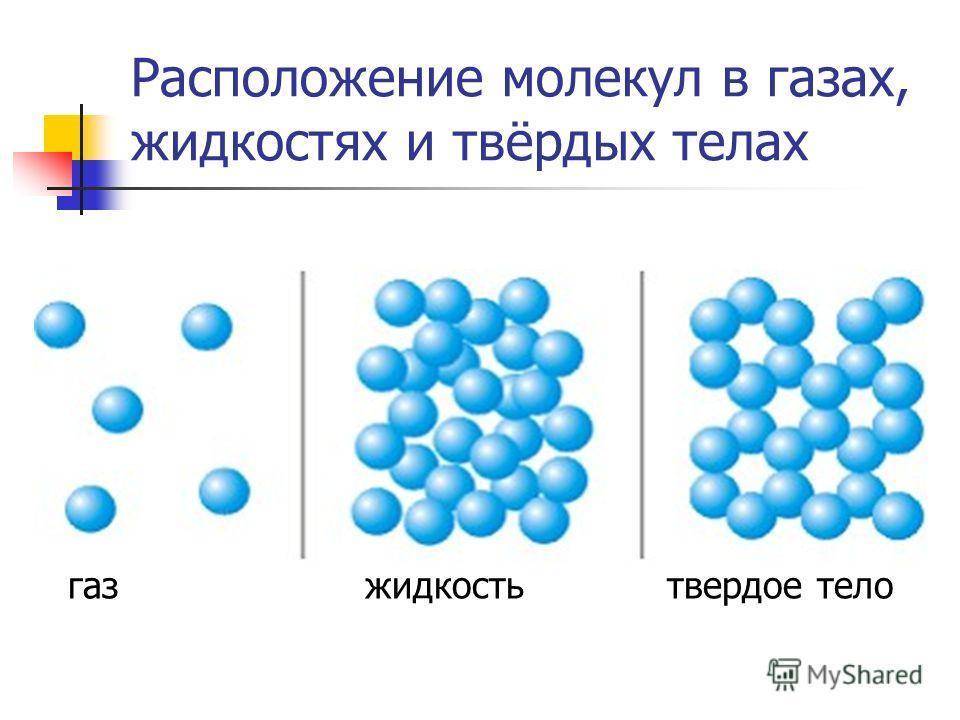
Вы уже знаете, что молекулы одного и того же вещества в твёрдом, жидком и газообразном состоянии ничем не отличаются друг от друга. То или иное агрегатное состояние определяется взаимным расположением составляющих вещество молекул, а также характером их движения и взаимодействия.
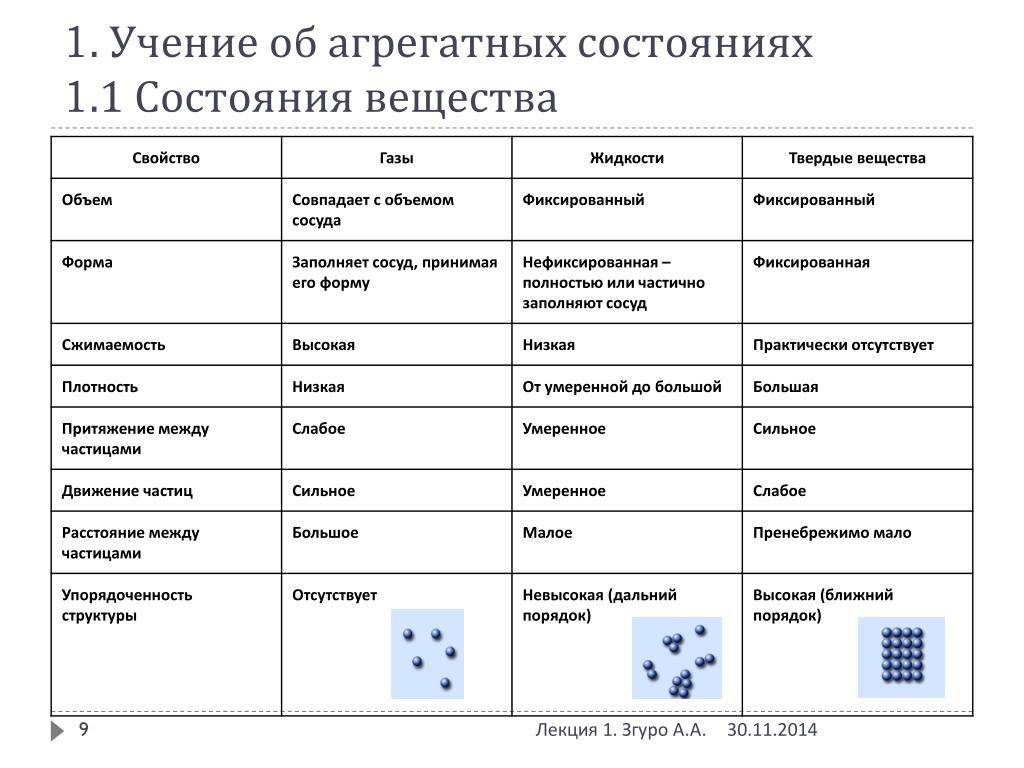
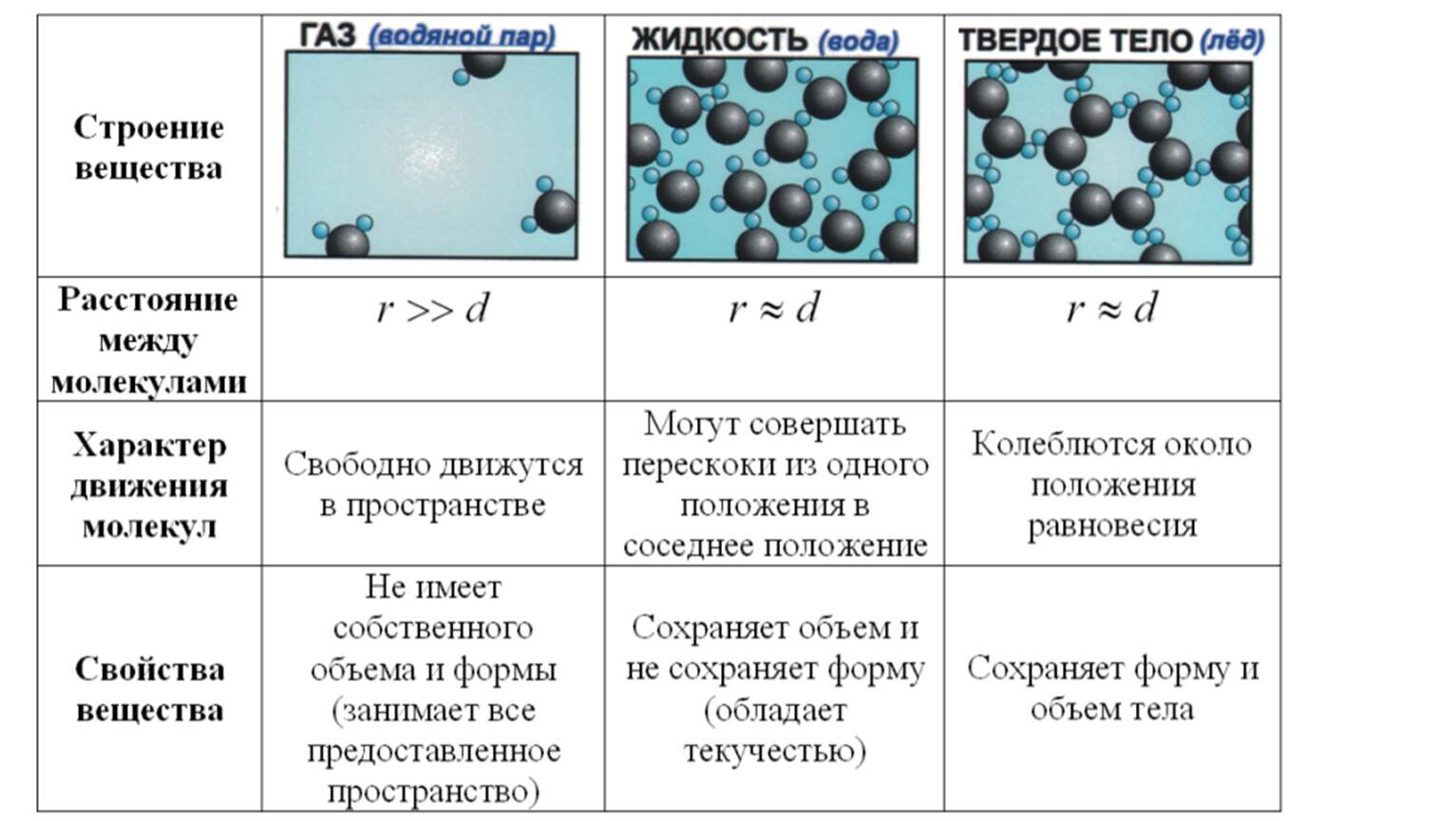
В газах при атмосферном давлении расстояния между молекулами намного больше размера самих молекул. Именно поэтому притяжение между молекулами газа мало. При обычных температурах средняя кинетическая энергия молекул газа вполне достаточна для совершения работы по преодолению сил их взаимного притяжения, поэтому молекулы газа разлетаются, если газ не сдерживают стенки сосуда.
Плотности жидкостей и твёрдых тел во много раз больше плотности газа, а их молекулы расположены гораздо ближе друг к другу. В этом случае сила взаимного притяжения молекул намного больше и средней кинетической энергии молекул уже недостаточно для того, чтобы совершить работу по преодолению сил межмолекулярного притяжения. Это является причиной того, что молекулы в жидкостях и особенно в твёрдых телах не могут значительно удаляться друг от друга.
https://youtube.com/watch?v=okKuP4B1YWw
ПЕРЕХОД ВЕЩЕСТВА ИЗ ОДНОГО АГРЕГАТНОГО СОСТОЯНИЯ
Вещества могут переходить из одного агрегатного состояния в другое. Изменение агрегатного состояния вещества всегда связано с выделением или поглощением некоторого количества теплоты.
Переход вещества из одного агрегатного состояния в другое используется для решения огромного числа практических задач. Например, в крупных городах используют снегоплавильные машины, для того чтобы грязный снег с улицы отправлять в канализацию и не загрязнять окружающую среду. На тепловых и атомных электростанциях в паровых турбинах применяют водяной пар. Сжиженный газ (фреон) используют в холодильных установках.
Всего различают шесть процессов, при которых происходит переход вещества из одного агрегатного состояния в другое.
ПЛАВЛЕНИЕ И КРИСТАЛЛИЗАЦИЯ
Переход вещества из твёрдого состояния в жидкое называется плавлением. В твёрдых телах, в отличие от жидкостей, частицы расположены упорядоченно. Поэтому, для того чтобы перевести частицы из упорядоченного состояния в неупорядоченное, нужно совершить работу по преодолению сил молекулярного притяжения. Внутренняя энергия вещества при этом увеличивается за счёт увеличения энергии взаимодействия молекул. Примерами плавления могут служить таяние льда, плавление металлов в металлургии и пр.
https://youtube.com/watch?v=es5o-C90krY
Обратный процесс, связанный с переходом вещества из жидкого состояния в твёрдое, называется кристаллизацией или отвердеванием. Пример кристаллизации — замерзание воды. Процесс кристаллизации сопровождается уменьшением внутренней энергии вещества за счёт уменьшения энергии взаимодействия молекул.
ПАРООБРАЗОВАНИЕ И КОНДЕНСАЦИЯ
Переход вещества из жидкого состояния в газообразное называется парообразованием. Пример парообразования — испарение воды.
Обратный процесс, связанный с переходом вещества из газообразного состояния в жидкое, называется конденсацией (от лат. condense — уплотнение, сгущение). Пример конденсации — образование росы.
СУБЛИМАЦИЯ (ВОЗГОНКА) И ДЕСУБЛИМАЦИЯ
Переход вещества из твёрдого состояния в газообразное (минуя жидкое) называется сублимацией (от лат. sublimo — возношу) или возгонкой. Возгонкой объясняются также запахи, которыми обладают многие твёрдые тела. Вылетая из твёрдого тела, молекулы образуют над ним газ (или пар), который и вызывает запах. Например, разные сорта древесины имеют различный запах.
Переход вещества из газообразного состояния в твёрдое (минуя жидкое) называется десублимацией. Пример десублимации — образование на окнах зимой инея, узоров из кристалликов льда. Данный процесс десублимации может осуществляться только на внутренней поверхности оконного стекла, где молекулы паров воды превращаются в кристаллики льда.
Вы смотрели Конспект по физике для 8 класса «Агрегатные состояния вещества».
Вернуться к Списку конспектов по физике (Оглавление).
Просмотров: 7 036
Газообразное состояние
При нормальных условиях (273 К, 101325 Па) в газообразном состоянии могут находиться как простые вещества, молекулы которых состоят из одного атома (Не, Ne, Ar) или из нескольких несложных атомов (Н2, N2, O2), так и сложные вещества с малой молярной массой (СН4 , HCl, C2H6).
Поскольку кинетическая энергия частиц газа превышает их потенциальную энергию, то молекулы в газообразном состоянии непрерывно хаотически двигаются. Благодаря большим расстояниям между частицами силы межмолекулярного взаимодействия в газах настолько незначительны, что их не хватает для привлечения частиц друг к другу и удержания их вместе. Именно по этой причине газы не имеют собственной формы и характеризуются малой плотностью и высокой способностью к сжатию и к расширению. Поэтому газ постоянно давит на стенки сосуда, в котором он находится, одинаково во всех направлениях.
Для изучения взаимосвязи между важнейшими параметрами газа (давление Р, температура Т, количество вещества n, молярная масса М, масса m) используется простейшая модель газообразного состояния вещества — идеальный газ, которая базируется на следующих допущениях:
- взаимодействием между частицами газа можно пренебречь;
- сами частицы являются материальными точками, которые не имеют собственного размера.
Наиболее общим уравнением, описывающим модель идеального газа, считается уравнения Менделеева-Клапейрона для одного моля вещества:
Однако поведение реального газа отличается, как правило, от идеального. Это объясняется, во-первых, тем, что между молекулами реального газа все же действуют незначительные силы взаимного притяжения, которые в определенной степени сжимают газ. С учетом этого общее давление газа возрастает на величину a/V2, которая учитывает дополнительное внутреннее давление, обусловленное взаимным притяжением молекул. В результате общее давление газа выражается суммой Р+ а/V2. Во-вторых, молекулы реального газа имеют хоть и малый, но вполне определенный объем b , поэтому действительный объем всего газа в пространстве составляет V — b. При подстановке рассмотренных значений в уравнение Менделеева-Клапейрона получаем уравнение состояния реального газа , которое называется уравнением Ван-дер-Ваальса:
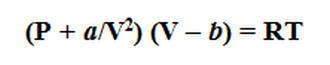
где а и b — эмпирические коэффициенты, которые определяются на практике для каждого реального газа. Установлено, что коэффициент a имеет большую величину для газов, которые легко сжижаются (например, СО2 , NH3 ), а коэффициент b — наоборот, тем выше по величине, чем больше размеры имеют молекулы газа (например, газообразные углеводороды).
Уравнение Ван-дер-Ваальса гораздо точнее описывает поведение реального газа, чем уравнения Менделеева-Клапейрона, которое тем не менее, благодаря наглядному физическому смыслу широко используется в практических расчетах. Хотя идеальное состояние газа является предельным, мнимым случаем, однако простота законов, которые ему отвечают, возможность их применения для описания свойств многих газов в условиях низких давлений и высоких температур делает модель идеального газа очень удобной.
Газообразное состояние
Газы не способны сохранять ни свой объем, ни форму. Заполним колбу доверху кислородом (его химическая формула О 2) . Как только мы откроем колбу, молекулы вещества начнут смешиваться с воздухом в помещении. Это происходит благодаря броуновскому движению. Еще древнегреческий ученый Демокрит считал, что частички вещества находятся в постоянном движении. В твердых телах при обычных условиях у атомов, молекул, ионов нет возможности покинуть кристаллическую решетку, освободиться от связей с другими частицами. Такое возможно только при поступлении большого количества энергии извне.
В жидкостях расстояние между частицами немного больше, чем в твердых телах, им требуется меньше энергии для разрыва межмолекулярных связей. К примеру, жидкое агрегатное состояние кислорода наблюдается только при снижении температуры газа до −183 °C. При −223 °C молекулы О 2 образуют твердое вещество. При повышении температуры сверх приведенных значений кислород превращается в газ. Именно в таком виде он находится при обычных условиях. На промышленных предприятиях действуют специальные установки для разделения воздуха атмосферы и получения из него азота и кислорода. Сначала воздух охлаждают и сжижают, а затем постепенно повышают температуру. Азот и кислород превращаются в газы при разных условиях.
Атмосфера Земли содержит 21 % по объему кислорода и 78 % азота. В жидком виде эти вещества в газовой оболочке планеты не встречаются. Жидкий кислород имеет светло-синий цвет, им при высоком давлении заполняют баллоны для использования в медицинских учреждениях. В промышленности и строительстве сжиженные газы необходимы для проведения очень многих процессов. Кислород нужен для газовой сварки и резки металлов, в химии — для реакций окисления неорганических и органических веществ. Если открыть вентиль кислородного баллона, давление уменьшается, жидкость превращается в газ.
Сжиженные пропан, метан и бутан находят широкое применение в энергетике, на транспорте, в промышленности и хозяйственно-бытовой деятельности населения. Получают эти вещества из природного газа или при крекинге (расщеплении) нефтяного сырья. Углеродные жидкие и газообразные смеси играют важную роль в экономике многих стран. Но запасы нефти и природного газа сильно истощены. По оценкам ученых, этого сырья хватит на 100-120 лет. Альтернативный источник энергии – воздушный поток (ветер). Используются для работы электростанций быстротекущие реки, приливы на берегах морей и океанов.

Кислород, как и другие газы, может находиться в четвертом агрегатном состоянии, представляя собой плазму. Необычный переход из твердого состояния в газообразное — характерная черта кристаллического йода. Вещество темно-фиолетового цвета подвергается сублимации — превращается в газ, минуя жидкое состояние.
Девятое — высокая подвижность частиц газа
В газообразном состоянии частицы обладают достаточно большими промежутками между собой, в результате чего газ может занимать значительный объем в пространстве. По сравнению с твердым состоянием, где частицы жестко связаны и имеют фиксированное положение, газ обладает свободой перемещения.
Высокая подвижность частиц газа объясняется их энергией. Частицы газа обладают кинетической энергией, которая определяется их скоростью движения. Эта энергия пропорциональна температуре газа и может быть измерена с помощью физических величин, таких как средняя кинетическая энергия или средняя скорость частиц газа.
Высокая подвижность частиц газа имеет ряд последствий. Она позволяет газу заполнять любые имеющиеся объемы и с легкостью проникать во все доступные пространства. Также газ может мгновенно перемещаться из одной точки в другую, что делает его практичным для применения в технологиях, таких как транспортировка и системы отопления или охлаждения.
Подвижность частиц газа связана с их слабыми взаимодействиями. В газообразном состоянии частицы обладают низкой силой притяжения друг к другу, и это позволяет им свободно двигаться. Однако, в некоторых условиях, таких как высокое давление или низкая температура, вещество может претерпевать фазовые переходы и переходить из газообразного состояния в жидкое или твердое. В таких случаях, подвижность частиц газа может значительно ограничиваться.
| Характеристика | Газообразное состояние | Твердое состояние |
|---|---|---|
| Подвижность частиц | Высокая | Ограниченная |
| Промежутки между частицами | Большие | Малые |
| Силы взаимодействия | Слабые | Сильные |
| Энергия частиц | Высокая | Низкая |
Точка кипения
Пожалуй, самое распространенное явление перехода жидкого состояния в газообразное в быту — это кипение воды. Заваривая чай каждый из нас мог наблюдать рождение процесса кипения воды. Маленькие пузырьки пара в толще подогревающейся воды постепенно растут и достигая критических размеров начинают подниматься на поверхность, где лопаясь превращаются в газообразное состояние — пар.
Как и в случае с плавлением существует граничная температура, называемая точкой кипения, при которой кинетическая энергия становится достаточной для того, чтобы преодолеть силы взаимного притяжения частиц, не дающие оторваться друг от друга и покинуть занимаемый объем. Любой элемент таблицы Менделеева или вещество из нескольких элементов имеет свою точку кипения. Чистая дистиллированная вода (H2O) имеет температуру кипения 100 С, этиловый спирт — (-79 С), а высококонцентрированная серная кислота кипит при температуре 338 С.
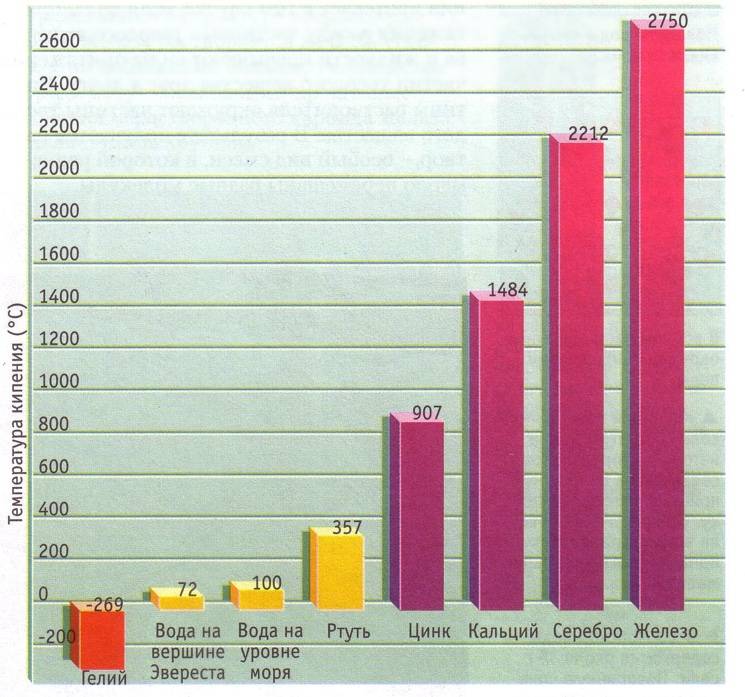
Температура кипения также зависит от давления и сил притяжения между частицами.
На вершине Эвереста температура кипения воды на 28 С ниже, чем внизу, над уровнем моря.
Однако, существуют исключения, при котором вещества могут миновать при переходе из одного агрегатного состояния в другую целую фазу превращения — переходя из твердого сразу в газообразную. Этот эффект называют сублимацией или возгонкой.
https://youtube.com/watch?v=9GU1dLJIfIM
Видео подборки опытов с сухим льдом
В качестве примера можно привести превращение сухого льда (диоксид углерода в твердом виде сразу в газообразное при температуре -78,5 С.